Ведение пациента с хроническим гепатитом B. Часть 3
Длительная монотерапия Энтекавиром и Тенофовиром ингибирует прогрессирование заболевания,...
Специалистам / Практика / Практика (статья)
 ГепатитПРОДОЛЖЕНИЕ. НАЧАЛО ЗДЕСЬ: «Ведение пациента с хроническим гепатитом B. Часть 1»
ГепатитПРОДОЛЖЕНИЕ. НАЧАЛО ЗДЕСЬ: «Ведение пациента с хроническим гепатитом B. Часть 1»
Данные рекомендации разработаны экспертами, прошли независимую оценку и были одобрены руководящим комитетом EASL. Разработка клинических рекомендаций основывалась на доказательствах из имеющихся публикаций, а в случае их отсутствия — на личном опыте и мнении экспертов. Всем доказательствам и рекомендациям, послужившим основой для данных клинических рекомендаций, присваивалась оценка по системе GRADE (Grading of Recommendations Assessment Development and Evaluation — шкала качества использованных доказательств, разработки и оценки рекомендаций).
Основная цель терапии пациентов с хронической HBV-инфекцией — повышение продолжительности и качества жизни путем предотвращения прогрессирования патологии, и, следовательно, снижения риска развития гепатоцеллюлярной карциномы. Кроме этого, целью противовирусной терапии является предотвращение распространение инфекции от матери ребенку, реактивации гепатита В, а также профилактика и лечение внепеченочных осложнений, обусловленных с HBV-инфекцией.
Вероятность достижения этих целей зависит от длительности терапии во время естественного течения болезни, стадии патологии, возраста пациента, периода, когда было начато лечение. Регрессию фиброза и цирроза можно рассматривать как дальнейшую цель лечения пациентов у которых наблюдаются осложнения, хотя влияние лечения и его воздействие на данные состояния не было полностью выяснено в клинических исследованиях. Стратегия лечения и профилактики развития рака печени может отличаться от тех, которые применяются для предотвращения прогрессирования фиброза.
У пациентов с HBV-индуцированной гепатоцеллюлярной карциномой основной целью терапии нуклеотидными аналогами является:
Стабилизация HBV-индуцированной патологии печени может также рассматриваться как необходимое условие профилактики и эффективного последующего лечения гепатоцеллюлярной карциномы.
Предупреждение развития острой или подострой печеночной недостаточности у пациентов с острым гепатитом B является основной целью лечения. Также важно всеми имеющимися способами улучшить качество жизни пациента путем сокращения продолжительности заболевания, снижения выраженности симптомов, а также снижение риска хронизации патологии.
Уровень репликации вируса гепатита B – единственный биомаркер, который указывает на степень прогрессирования патологии; показатель уровня этого маркера позволяет прогнозировать исход и течение хронической HBV-инфекции. Ингибирование репликации HBV, путем противовирусного лечения, позволяет устранить воспалительно-некротические изменения и фиброз, которые наблюдаются при хронической HBV-инфекции и, как следствие, снижает риск развития рака печени. Именно такой результат является желаемым при проведении противовирусного лечения. Уровень подавления ДНК HBV, который необходимо достигнуть для получения такого результата, еще недостаточно определен, но специалисты утверждают, что чем ниже уровень ДНК HBV, тем лучше.
Вызванная лечением элиминация HBeAg и сероконверсия к анти-HBe часто характеризует индукцию частичного иммунного контроля, приводит к фазе низкой репликации хронической инфекции HBV. И только после лечения можно определить наступит ли эта длительная фаза. После прекращения терапии может произойти серореверсия HBeAg, а также может развиться HBeAg-отрицательная хроническая HBV (даже после лечения нуклеотидными аналогами), что в принципе не желательно. Следовательно, продолжение пероральной противовирусной терапии, независимо от реакции HBeAg и до элиминации HBsAg, является альтернативной стратегией лечения таких пациентов.
Подавление ДНК HBV до самого низкого уровня часто наблюдается на фоне нормального показателя уровня активности АЛТ. Повышенный уровень активности АЛТ у пациентов с полным подавлением вирусной репликации свидетельствует о меньшей вероятности регрессии фиброза и может быть причиной гистологической активности патологии. Наиболее вероятным объяснением такого состояния является наличие сопутствующих повреждений печени (например, алкогольная или безалкогольная жировая дистрофия печени). И наоборот, кратковременные вспышки активности АЛТ могут свидетельствовать о восстановлении иммунитета (в некоторой степени), и может указывать на благоприятный исход.
Идеальным результатом лечения является элиминация HBsAg, «функциональное излечение». Однако такой результат редко достигается имеющимися методам противовирусной терапии. Спонтанная серореверсия HBsAg с реактивацией воспалительного процесса печени после элиминации HBsAg наблюдается редко и может возникать у пациентов с существенным нарушением функции иммунной системы. Основным преимуществом элиминации HBsAg является возможность безопасно прекратить противовирусную терапию. Поскольку хроническая HBV-инфекция не может быть полностью ликвидирована в связи с сохранением cccDNA и интегрированной ДНК HBV, остается неясным, действительно ли элиминация HBsAg ведет к предотвращению долгосрочных осложнений хронической HBV-инфекции, что может быть достигнуто посредством подавления репликации ДНК HBV. Риск развития рака печени сохраняется, даже после спонтанной элиминации HBsAg (годовой показатель риска составляет примерно 0,55%). Однако риск развития гепатоцеллюлярной карциномы ниже, если элиминация HBsAg происходит в более молодом возрасте и/или на фоне незначительного фиброза печени. Исследования показали, что среди населения азиатского происхождения из 287 пациентов, после проведенного лечения нуклеотидными аналогами и с индуцированной элиминацией HBsAg, только у 2 больных з циррозом печени развилась гепатоцеллюлярная карцинома, либо настала смерть (годовой показатель риска составляет 0,7%); этот показатель значительно ниже по сравнению с показателями среди больных с совпадением маркеров предрасположенности к заболеванию без элиминации HBsAg.
Показания к лечению, как правило, одинаковы как для HBeAg-положительной, так и для HBeAg-отрицательной хронической HBV-инфекции. Это основано, главным образом, на сочетании следующих трех критериев:
Больные без цирроза должны получать лечение при показателе уровня ДНК HBV выше 2000 МЕ/мл, высоком показателе уровня АЛТ (примерно 40 МЕ/мл) и в случае наличия признаков умеренного воспалительно-некротического поражения печени и/или, по меньшей мере, умеренный фиброз (гистологическое исследование). Пациенты с показателем ДНК HBV > 20000 МЕ/мл и уровнем АЛТ, превышающем показатель верхней границы нормы минимум в 2 раза, должны получать противовирусную терапию даже без проведения биопсии печени. Конечно, биопсия печени может предоставить дополнительную полезную диагностическую информацию, но обычно она не меняет стратегии лечения. Доступные неинвазивные методы оценки степени фиброза используются у больных, которые начали лечение без проведения биопсии, для подтверждения или исключения цирроза печени.
При показателе уровня ДНК HBV > 2000 МЕ/мл и хотя бы умеренным фиброзом, лечение может быть начато, даже если уровень активности АЛТ находится в пределах нормы. У пациентов, которые не могут или не хотят проводить биопсию печени, неинвазивные методы выявления фиброза также могут быть использованы для принятия решений по назначению терапии.
Рекомендации CPGs EASL-ALEH по «неинвазивным методам оценки тяжести патологии печени и прогноза заболевания», фиброз или цирроз тяжелой степени наблюдается у пациентов с хронической HBV-инфекцией у которых определяется либо нормальная активность АЛТ и степень уплотнения печени > 9 кПа (при проведении транзиторной эластографии), либо с повышенной активностью АЛТ (выше нормы, но не более чем в 5 раз выше нормы) и степенью уплотнения печени > 12 кПа. Также могут быть использованы дополнительные методы диагностики хронической HBV-инфекции, кроме серологических и эластографических.
При назначении лечения нужно учитывать возраст пациента, семейный анамнез, состояние здоровья, вероятность передачи HBV-инфекции, наличие осложнений (рак печени, цирроз, внепеченочные проявления).
Пациенты, не подлежащие лечению, должны периодически обследоваться для оценки уровня активности АЛТ в крови, уровня ДНК HBV и определения тяжести фиброза неинвазивными методами диагностики. Те пациенты, у которых наблюдается HBeAg-положительная хроническая HBV-инфекция, но они не принимают лечения, в идеале должны делать анализ на уровень АЛТ по крайней мере каждые 3 месяца, а также определять уровень ДНК HBV каждые 6-12 месяцев и проводить оценку степени фиброза каждые 12 месяцев.
Пациенты с HBeAg-отрицательной хронической HBV-инфекцией и HBV ДНК < 2000 МЕ/мл должны определять уровень активности АЛТ каждые 6-12 месяцев, а также определять уровень HBV ДНК и проводить оценку степени фиброза печени с периодичностью 1 раз в 2-3 года. Количественное определение уровня HBsAg может быть полезным в решении вопроса о частоте последующего наблюдения пациентов. Если уровень HBsAg < 1000 МЕ/мл, то уровень активности АЛТ можно определять каждые 12 месяцев, а определение уровня HBV ДНК и оценку степени фиброза печени можно проводить каждые 3 года, в то время как наблюдение пациентов с уровнем HBsAg ≥ 1000 МЕ/мл нужно проводить следующим образом: определение уровня активности АЛТ каждые 6 месяцев, определения уровня HBV ДНК и оценку степени фиброза печени хотя бы 1 раз в 2 года.
Пациенты с HBeAg-отрицательной хронической HBV-инфекцией и уровнем HBV ДНК ≥ 2000 МЕ/мл должны следить за уровнем активности АЛТ не реже 1 раз в 3 месяца в течение первого года, далее — каждые 6 месяцев. Оценку уровня HBV ДНК и степени фиброза печени неинвазивным методом диагностики следует проводить каждый год в течение как минимум 3-х лет. Если такие пациенты не имеют никаких показаний к лечению на протяжении 3-х летнего периода наблюдения, они должны наблюдаться так же, как и другие пациенты в этой фазе.
В настоящее время существуют два основных варианта лечения хронического гепатита В: лечение нуклеотидными аналогами или IFNα, в настоящее время пегилированный (PegIFNα). К нуклеотидным аналогам, которые были утверждены в Европе для лечения вирусного гепатита B относятся Ламивудин, Адефовир Дипивоксил, Энтекавир, Телбивудин, Тенофовир (Тенофовир Дизопроксил Фумарат) и Тенофовир Алафенамид. Эти противовирусные препараты классифицируются на две группы: с низким барьером к развитию устойчивости к вирусу гепатита B (Ламивудин, Адефовир Дипивоксил, Телбивудин), а также препараты с высоким барьером к развитию устойчивости (Энтекавир, Тенофовир, Тенофовир Алафенамид).
Основным преимуществом лечения мощными нуклеотидными аналогами с высоким барьером к развитию устойчивости (Энтекавир, Тенофовир, Тенофовир Алафенамид) является их сильный, долгосрочный противовирусный эффект, позволяющий значительно снизить уровня ДНК HBV у большинства пациентов, соблюдающих правила приема препаратов; также эти препараты считаются самыми безопасными – их можно безопасно использовать в лечении пациентов инфицированных HBV-инфекцией, кроме того они представляют собой единственный вариант лечения для нескольких подгрупп пациентов, в том числе и с декомпенсированными патологиями печени, после трансплантации печени, внепеченочными осложнениями, при остром гепатите В или обострения хронического гепатита B тяжелой степени. Нуклеотидные аналоги являются единственным вариантом для предотвращения реактивации вируса гепатита B у пациентов с иммуносупрессией, а также предупредить распространение HBV-инфекции у пациентов с высокой виремией, которые не получали лечение по типичной схеме (заключается в дальнейшем лечении исключительно нуклеотидными аналогами).
Подход к лечению, основанный на применении PegIFNα (пегилированный интерферон альфа), заключается в проведении курса лечения и стимуляции долгосрочного иммунологического контроля патологии. Основными недостатками лечения PegIFNα является высокая вариабельность реакции в ответ на лечение, небезопасность, и, следовательно, небольшое количество пациентов, желающих получать такое лечение. Чтобы предсказать реакцию пациента на лечение, индивидуальную реакцию на PegIFNα следует учесть такие факторы как: активность заболевания, генотип HBV, стадия заболевания, а также уровни HBV, HBsAg и HBeAg (эти показатели можно использовать для прогнозирования вероятности индивидуального ответа). Ранние предикторы лечения могут использоваться как дополнительные инструменты (например, для определения правил отмены лечения) для индивидуализации стратегии лечения, что, в свою очередь, помогает отменить PegIFNα на ранних этапах и снизить вероятность долгосрочной реакции на терапию.
Теоретически, комбинированное лечение нуклеотидными аналогами и PegIFNα может обеспечить мощный противовирусный эффект (нуклеотидные аналоги + иммунная модуляция IFNα). Однако, отсутствуют доказательства преимущества применения такого комбинированного подхода к лечению, и по-прежнему существует много нерешенных вопросов, касающихся выбора времени, пациентов, продолжительности комбинации препаратов. Эти вопросы, возможно, будут рассмотрены в дальнейших исследованиях.
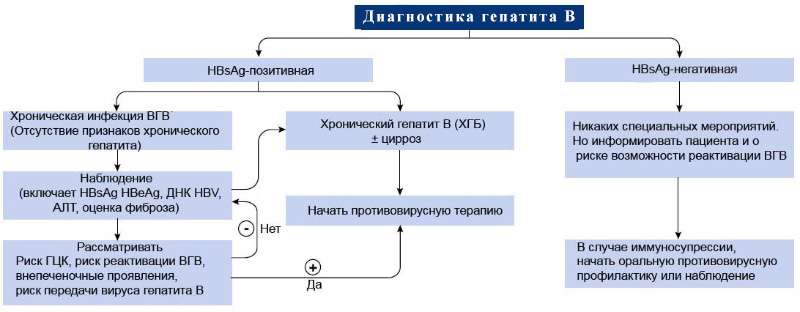
Алгоритм лечение гепатита B
Ответ на проведенное лечение условно делят на 4 типа: вирусологический, серологический, биохимический и гистологический, которые, в свою очередь, разделяют на несколько этапов, во время и после лечения. Вирусологический ответ варьируется в зависимости от времени (во время или после терапии) и вида терапии.
Серологический ответ HBeAg – это элиминация и сероконверсия HBeAg, то есть снижение уровня HBeAg и развитие анти-HBe (только у HBeAg-положительных пациентов).
Серологический ответ HBsAg – это элиминация и сероконверсия HBsAg, то есть снижение уровня HBsAg и развитие анти-HBs (для всех пациентов).
Биохимический ответ
Биохимический ответ определяется нормализацией показателей уровня АЛТ в соответствии с референсными значениями. Так как уровень АЛТ часто колеблется, минимальный строк наблюдения должен проводится по крайней мере 1 год после окончания лечения, с определением уровня активности АЛТ каждые 3 месяца для подтверждения устойчивого биохимического ответа на лечение. Отметим, что частоту стойкого биохимического ответа после окончания лечения иногда сложно оценить, поскольку временное повышение активности АЛТ перед достижением долгосрочной биохимической ремиссии может возникать у некоторых пациентов с хроническим течением инфекции в первый год после прекращения лечения. В таких случаях рекомендуется проводить дополнительное прицельное определение уровня активности АЛТ в течение 2 лет после повышения его уровня для подтверждения стабильной биохимической ремиссии.
Гистологический ответ характеризуется снижением активности воспалительно-некротического процесса (≥ 2 баллов по шкале HAI или системе Ishak) без усиления выраженности фиброза по сравнению с исходными данными.
|
Особенности |
PegIFNα |
Энтекавир / Тенофовир Дизопроксил Фумарат / Тенофовир Алафенамид |
|
Способ введения |
Подкожная инъекция |
Перорально |
|
Длительность |
48 недель |
Долгосрочный прием до момента элиминации HBsAg (в некоторых случаях допускается прекращение приема нуклеотидных аналогов после нескольких лет приема) |
|
Переносимость |
Низкая |
Высокая |
|
Безопасность при долгосрочном применении |
Побочные эффекты возникают редко (со стороны эндокринной или нервной системы, могут отмечаться психические нарушения) |
Безопасно (отсутствуют данные о влиянии препаратов на функцию почек; иногда могут возникать патологии костной системы) |
|
Противопоказания |
Много (например, патология в стадии декомпенсации, сопутствующие патологии и др) |
Отсутствуют (при определении дозы препарата необходимо учитывать показатель скорости клубочковой фильтрации). Коррекция дозы у больных с СКФ < 50 мл/мин требуется для всех нуклеотидных аналогов (кроме Тенофовир Алафенамид – рекомендованная доза для больных с клиренсом креатинина < 15 мл/мин, без необходимости проведения гемодиализа) |
|
Стратегия лечения |
Желаемый результат лечения - индукция долгосрочного иммунного контроля |
Остановка прогрессирования гепатита, путем ингибирования репликации вируса |
|
Уровень супрессии вируса |
Умеренный (переменная реакция) |
Высокий |
|
Степень элиминации HBeAg |
Умеренный, в зависит от базовых характеристик |
Низкий в течении первого года, увеличивается до умеренного уровня в течение длительного периода лечения |
|
Степень элиминации HBsAg |
Переменный, в зависимости от базовых характеристик (но выше по сравнению с нуклеотидными аналогами) |
Низкий: медленно увеличивается с временем лечения в HBeAg-положительных пациентов (стабилизация серологических показателей отмечается после 4-х лет лечения); как правило, очень низкий у HBeAg-негативных пациентов |
|
Риск рецидива после прекращения лечения |
Малая вероятность для лиц с устойчивым ответом через 6-12 месяцев после лечения |
Умеренный, если лечение проводится после сероконверсии HBeAg |
|
Правила ранней отмены лечения |
Да |
Нет |
|
Риск развития вирусной резистентности |
Нет |
Минимальный (в настоящий момент не зафиксированы случаи развития резистентности к Тенофовир Дизопроксил Фумарату и Тенофовир Алафенамиду) |
Эффективность всех нуклеотидных аналогов была оценена в рандомизированных контролируемых клинических испытаниях в ІІІ фазе. Стратегия лечения нецирротической и компенсированной цирротической HBV-инфекции одинакова, учитывая эффективность и безопасность длительной терапии с помощью нуклеотидных аналогов. При лечении Энтекавиром HBeAg-положительных пациентов с хроническим гепатитом B на протяжении 5 лет, достигается кумулятивная вероятность вирусологического ответа в 99% и 53% вероятности элиминации HBeAg. После 5 лет лечения Тенофовиром у 97% пациентов с HBeAg-положительным хроническим гепатитом B отмечался вирусологический ответ, у 73% - нормальный показатель уровня активности АЛТ, в то время как потеря HBeAg наблюдалась в 49% случаев, сероконверсия HBeAg – в 40%, потеря HBsAg – в 10% и сероконверсии HBsAg – в 8%.
У пациентов с HBeAg-отрицательным хроническим гепатитом B после пятилетний терапии Энтекавиром кумулятивная вероятность вирусологического и биохимического ответа составляла 98% и 95% соответственно, тогда как показатель резистентности к Энтекавиру был < 1%. Через 8 лет 99% HBeAg-отрицательных пациентов с хронической HBV-инфекцией, получавших Тенофовир в процессе регистрации, достигли вирусологический ответ (ДНК HBV < 400 копий/мл) без признаков резистентности к Тенофовиру, у 88% пациентов уровень активности АЛТ был в пределах нормы. В течение 3-4 лет лечения Тенофовиром у HBeAg-отрицательных пациентов с хроническим гепатитом B в реальной практике вирусологический ответ колебался от 92% до 100% без проявление резистентности к Тенофовиру, в то время как у 75% пациентов нормализовался уровень активности АЛТ. Ни у одного из HBeAg-отрицательных пациентов с хроническим гепатитом В не наблюдалась элиминация HBsAg в первый год терапии Энтекавиром или Тенофовиром и лишь немногие (< 1%) достигли этого результата во время долгосрочной (8 летней) терапии.
У пациентов с HBeAg-положительным хроническим гепатитом B признаки вирусологического ответа на лечение Тенофовир Алафенамидом составили 64% на 48 неделе и 75% на 96 неделе терапии. Элиминация HBeAg и сероконверсия анти-HBe были достигнуты у 14% и у 10% пациентов на 48 неделе и 22% и 18% на 96 неделе, соответственно. В том же исследовании частота нормализации уровня АЛТ на 96 неделе по традиционным показателям была выше у пациентов, получавших Тенофовир, чем у тех кто получал Тенофовир Алафенамид (75% и 68%), тогда как только 1% пациентов достигли элиминации HBsAg. 94% HBeAg-отрицательные пациенты с хроническим гепатитом B, принимающие тенофовир, достигли вирусологической ответ на 48 неделе, который поддерживался, в большинстве случаев на 96 неделе (90%). И только один HBeAg-отрицательный пациент (< 1%) с хронической HBV-инфекцией, принимавший Тенофовир, достиг элиминиции HBsAg на 96 неделе.
Аналогичные вирусологические и серологические результаты наблюдались у пациентов, принимающих в качестве противовирусного лечения Тенофовир Алафенамид (результаты исследования на 96 неделе не доступны на данный момент).
Все пациенты, которые принимали нуклеотидные аналоги в качестве лечения, с высоким барьером резистентности (к Энтекавиру, Тенофовиру и Тенофовир Алафенамиду) периодически должны проходить обследования. К этим обследованиям относятся: общий анализ крови, биохимический анализ крови (СКФ, уровень щелочной фосфатазы в крови) функциональные тесты, определение уровня ДНК HBV с помощью высокочувствительной ПЦР. Рекомендуются соответствующие корректировки дозировки Энтекавира и Тенофовира пациентам с СКФ < 50 мл/мин. Дозировка Теккофовир Алефенамида остается 25 мг при СКФ < 15 мл/мин, с моделированием фармакокинетических данных, нет необходимости изменения дозы при СКФ < 15 мл/мин при поддержке функции почек, чего не указано в инструкции (Vemlidy, SmPC). Кроме того, следует оценить риск почечной недостаточности у всех пациентов до начала терапии. К факторам высокого риска поражения почек относя один или несколько из следующих факторов: декомпенсированный цирроз печени, клиренс креатинина < 60 мл/мин, плохо контролируемая артериальная гипертензия, протеинурия, сахарный диабет в стадии декомпенсации, гломерулнефрит в стадии обострения, сопутствующая терапия нефротоксичными препаратами, трансплантация солидного органа.
Во время лечения должны проводиться печеночные пробы каждые 3-4 месяца в течение первого года, далее – каждые 6 месяцев. Уровень ДНК HBV следует определять каждые 3-4 месяца в течение первого года и каждые 6-12 месяцев после. HBsAg следует проверяться с интервалом в 12-месяцев, если ДНК HBV не обнаруживается во время элиминации HBsAg, тогда следует определить уровень анти-HBs.
Минимальная частота снижения функции почек описана при длительном лечении Энтекавиром и Тенофовиром, при лечении Текофовир Алафенамидом наблюдается высокий нефротоксический потенциал. Были зарегистрированы случаи синдрома Фанкони при терапии Тенофовиром, но они исчезали при переходе на Энтекавир.
При приеме Тенофовира у пациентов проявлялись симптомы хронического повреждения минеральной плотности костной ткани, собирательных трубочек нефронов, снижение СКФ, поэтому таким пациентам рекомендуется проводить оценку функции клубочков и трубочек нефронов, а также оценку минеральной плотности костной ткани. Следовательно, рекомендуется выявлять нежелательные эффекты со стороны почек путем определения уровня креатинина (а также клиренса креатинина) и щелочной фосфатазы в сыворотки при лечении Тенофовиром у всех больных хроническим гепатитом B. Кроме того, у всех больных с хроническим гепатитом B следует определять уровень креатини на (а также клиренса креатинина) во время лечения аналогами нуклеозидов у больных с хроническим гепатитом B и высоким риском почечных осложнений. Частое обследование должно проводиться у больных с риском почечных осложнений, т.е. каждые 3 месяца в первый год лечения, далее каждых 6 месяцев, при условии отсутствия осложнений. Более частая оценка функции почек требуется при клиренсе креатинина менее 60 мл/мин или уровне щелочной фосфатазы сыворотки менее 2 мг/дл.
При проведении испытаний Тенофовир Алафенамида, выяснилось, что этот препарат, по сравнению с Тенофовиром, имеет преимущество в воздействия на почечные маркеры (гломерулярный и тубулярный аппарат), а также способствует регрессу изменений в костной ткани на 48 и 96 неделе. Особенно существенные различия, отражающих функцию почек и изменения в костной ткани, отмечались на 48 неделе испытания. Значительное различие было отмечено в снижении СКФ в обеих исследованиях: - 0,6 мл/мин и - 5,4 мл/мин соответственно в HBeAg-положительных пациентов (p < 0,0001), - 1,8 мл/мин и 4,8 мл/мин у HBeA-отрицательных пациентов (p = 0,004). Аналогичное действие продемонстрировало изменения уровня креатенина в сыворотке у пациентов под воздействием Тенофовир Алафенамида и Тенофовира: у HBeAg-положительных пациентов при лечении Тенофовир Алафенамидом наблюдалось 0,01 мг/дл, а при лечении Тенофовиром - 0,03 мг/дл при приеме Тенофовир Дизопроксил Фумарата (p = 0,02); у HBeAg-отрицательных – 0,01 мг/дл и 0,02 мг/дл (р = 0,32). Также, значительно меньший процент снижения минеральной плотности костной ткани в бедренной кости наблюдалось у пациентов, которые получали Тенофовир Алафенамидм, чем у тех, кто принимал Тенофовир (- 0,10% по сравнению с -1,72% у HBeAg-положительных пациентов [p < 0.0001], - 0.29% к 2.16% у HBeAg-отрицательных пациентов [p < 0,0001], в позвоночнике – (- 0,42% к - 2,29%) у HBeAg-положительных пациентов, и - 0,88% и 2,51% соответственно у HBeAg-отрицательных. Дополнительные данные показали, что Тенофовир Алафенамид имеет более щадящее влияние на функции почек и на минеральный обмен в костной ткани чем Тенофовир, с более медленным прогрессом хронических заболеваний печени и костной ткани на 96 неделе лечения.
На данный момент нет точных долгосрочных исследовательских доказательств, однако подобные подтверждения преимущества применения Тенофовир Алафенамида над Тенофовиром при лечении ВИЧ-инфицированных пациентов с риском развития или с имеющейся почечной недостаточностью, или при снижении минеральной плотности ткани.
Эти данные также демонстрируют стабилизацию параметров почечной функции (СКФ, креатинина), уменьшение протеинурии, трубчатой протеинурии, (p < 0,001), а также денситометрия бедра и позвоночника указывает на улучшение состояния костной ткани по сравнении с исходными данными, на 48 неделе и на 96 неделе. Оправдают ли себя эти результаты в долгосрочных клинических исследованиях с больными хроническим гепатитом В, еще не известно, но оказывается, что предпочтительно назначать таким пациентам долгосрочную терапию нуклеотидными аналогами, принимая во внимание нарастающие темпы развития сопутствующей патологии и возрастные особенности пациентов страдающих хронической HBV-инфекцией. Таким образом, следует принимать во внимание особенности назначения терапии нуклеотидными аналогами пациентам старшего возраста, всеми методами предотвращать темпы развития физиологического и патологического прогрессирования остеопении и остеопороза, следить за функцией почек и уровнем СКФ. В таких подгруппах пациентов, выбором препарата будет Энтекавир или Тенофовир Алафенамид, последний так же будет препаратом выбора у пациентов, которые ранее принимали Ламивудин.
ПРОДОЛЖЕНИЕ ЗДЕСЬ: «Ведение пациента с хроническим гепатитом B. Часть 3»
Длительная монотерапия Энтекавиром и Тенофовиром ингибирует прогрессирование заболевания,...
До появления терапии нуклеотидными аналогами, рецидивирующая HBV-инфекция при трансплантации...
Анализы на определение уровня тиреоидных и тиреотропного гормонов в крови назначают не...
Вирусный гепатит С (ВГС) — одна из актуальных проблем современного здравоохранения. Это...
Хронический гепатит — это хронический воспалительный процесс в печени, который длится на...
анализы, БАД, биологическая медицина, витамины, гастроэнтерология, гигиена, гинекология, гомеопатия, дерматология, диагностика, диетология, заболевания, иммунология, инфекционные заболевания, инфекция, исследования, кардиология, кожа, косметика, красота, лекарственные растения, лечение, лицо, неврология, обследование, оздоровление, онкология, ортопедия, педиатрия, питание, пищеварительная система, поведение, похудение, препараты, продукты, профилактика, процедура, психология, пульмонология, рак, реабилитация, сердечно-сосудистая система, ССС, тело, терапия, травматология, уход, фитотерапия, хирургия, эндокринология
Показать все теги

Комменатрии к новости