Иммунитет справится с болезнью!
Специалисты утверждают, что каждая женщина хотя бы раз в жизни сталкивается с гинекологическим...
Специалистам / Практика / Практика (статья)
 Вирусный гепатит СВирусный гепатит С (ВГС) — одна из актуальных проблем современного здравоохранения. Это связано с его распространенностью в популяции, высокой частотой формирования осложнений и с внепеченочными проявлениями, определяющими трудности диагностики и терапии.
Вирусный гепатит СВирусный гепатит С (ВГС) — одна из актуальных проблем современного здравоохранения. Это связано с его распространенностью в популяции, высокой частотой формирования осложнений и с внепеченочными проявлениями, определяющими трудности диагностики и терапии.
По данным ВОЗ в настоящее время в мире насчитывается более 200 млн больных хроническим вирусным гепатитом С, а количество инфицированных вирусом гепатита С (HCV) достигает 500 млн чел. HCV является причиной 20% всех случаев острого вирусного гепатита С, у 75-85% инфицированных им людей в дальнейшем развивается хронический ВГС, исходом которого могут быть цирроз печени и гепатоцеллюлярная карцинома (ГЦК).
В США распространенность этой инфекции за период с 1999 по 2002 г. составляла 1,6%, что соответствует 4,1 млн лиц с выявленными антителами к HCV (анти-HCV антитела). У 80% анти-HCV положительных пациентов в сыворотке крови определяется рибонуклеиновая кислота (РНК) HCV, то есть имеется виремия.
В Украине в 2004-2009 гг. уровень заболеваемости составлял в среднем 7,03 случаев на 100 тыс. населения. Однако, по подсчетам специалистов, фактический уровень заболеваемости может в несколько раз превышать данные официальной статистики. Для сравнения — в США и странах Европы показатели заболеваемости составляют 1-3 случая на 100 тыс. По официальным данным в настоящее время в Украине зарегистрировано около 2 млн лиц, инфицированных HCV. По мнению многих специалистов, в действительности этот показатель составляет как минимум от 4 до 5 млн, а это примерно каждый двенадцатый житель нашей страны.
Расчеты показывают, что смертность, ассоциированная с вирусным гепатитом С (смерть от печеночной недостаточности или ГЦК), будет продолжать увеличиваться в течение предстоящих 20 лет. В связи с высокой стоимостью и зачастую недостаточной эффективностью противовирусной терапии, а также инвалидизацией потенциально трудоспособного населения, хронический вирусный гепатит С представляет собой не только социальную, но и существенную экономическую проблему.
Серьезность проблемы усугубляется также рядом особенностей клинического течения инфекции. Например, острая фаза при вирусном гепатите С зачастую протекает скрыто, при этом человек длительное время может не догадываться об инфицировании до момента возникновения существенных осложнений со стороны печени или случайного обнаружения повышения уровней аминотрансфераз. Пациент с вирусным гепатитом может длительное время испытывать лишь повышенную утомляемость, некоторое снижение работоспособности, в то время как поражение печени медленно, исподволь прогрессирует, а сам больной остается постоянным источником инфекции для окружающих. Чаще всего больные попадают в поле зрения врача уже со сформировавшимся ВГС или развившимся на его фоне циррозом. Такая особенность клинического течения вирусного гепатита С существенно затрудняет своевременную диагностику и дальнейшую терапию заболевания. Средние сроки от момента инфицирования и до установления диагноза могут составлять до 10 лет. При этом более чем у 70% пациентов на момент установления диагноза никаких клинических симптомов гепатита не выявляется. Не менее чем у 1% пациентов вирусный гепатит С впервые диагностируется на стадии цирроза.
К основным клиническим симптомам хронического вирусного гепатита С можно отнести немотивированную слабость, ощущение тяжести в правом подреберье, иногда субфебрилитет. К сожалению, указанные симптомы являются неспецифическими и могут быть обнаружены при многих других заболеваниях. Поводом для обследования больного на маркеры вирусных гепатитов может быть беспричинное повышение уровня сывороточных аминотрансфераз либо случайно обнаруженное расширение вен пищевода. Оптимальными методами выявления HCV-инфекции является активное использование эпидемиологических критериев путем сбора анамнеза с последующим целенаправленным обследованием тех, у кого факторы риска обнаружились. Как правило, при тщательном сборе анамнеза фактор риска удается выявить более чем у 90% HCV-инфицированных. В настоящее время внутривенное введение наркотиков является основным путем передачи вирусного гепатита С, соответственно, все лица, которые практикуют или ранее практиковали внутривенное введение наркотиков (даже однократное), должны быть обследованы на наличие HCV-инфекции. Кроме того, лица, перенесшие переливание крови или ее компонентов, либо трансплантацию органов до 1992 г., должны быть обследованы на предмет наличия HCV-инфекции.
Сходным образом лица с необъяснимым повышением уровня аминотрансфераз (аланиновой и/или аспарагиновой аминотрансфераз — АЛТ/АСТ) либо находившиеся когда- либо на гемодиализе, а также дети, рожденные от матерей, инфицированных вирусным гепатитом С, или пациенты с ВИЧ-инфекцией должны быть обследованы на предмет наличия HCV- инфекции. К другим потенциальным источникам HCV-инфекции относят сексуальные контакты с инфицированным партнером (или наличие большого количества сексуальных партнеров), постоянную работу с инфицированной кровью или продуктами крови, а также склонность к нанесению татуировок.
В лабораторной диагностике и мониторинге HCV-инфекции используют два основных подхода:
- серологические методы, основанные на обнаружении специфических антител к HCV (анти-HCV антител);
- молекулярно-биологические методы, основанные на обнаружении РНК вируса.
Методы анализа, основанные на обнаружении анти-HCV антител, используются как для скрининга, так и для диагностики HCV-инфекции. Специфичность современных тест- систем для иммуноферментного анализа (ИФА) анти-HCV антител превышает 99%.
Для выявления РНК HCV используют как качественные, так и количественные методы анализа. Ранее качественный анализ был более чувствителен, чем количественный. Но с появлением методов, основанных на полимеразной цепной реакции (ПЦР) в реальном времени и транскрипционно-опосредованной амплификации (ТОА) с нижним порогом чувствительности 10-15 МЕ/мл, необходимость в качественном определении РНК HCV постепенно отходит на второй план. В тоже время количественные методы определения РНК HCV дают представление о вирусной нагрузке, имеющей все большее значение для прогноза и мониторинга терапии вирусного гепатита С.
Генотипирование HCV играет важную роль как в эпидемиологических исследованиях, так и в клинической практике для определения оптимальной длительности терапии и прогнозирования вероятности ответа на нее. На основании 30% разницы в последовательности нуклеиновых кислот между изолятами HCV может быть отнесен к одному из 6 основных генотипов (с 1-го по 6-й). На территории Украины преобладающим генотипом является 1b (встречается в 80% случаев), далее с убывающей частотой идут 3a, 1a, 2a. В связи с глобальным увеличением международных контактов в последнее время все чаще встречаются менее распространенные в нашем регионе генотипы (4-6).
Ранее биопсия печени считалась золотым стандартом для определения статуса заболевания печени, однако ее недостатки ставят под вопрос клиническую ценность данной диагностической процедуры при вирусном гепатите С. В первых исследованиях, посвященных лечению вирусного гепатита С, без результатов биопсии ведение больных представлялось почти невозможным, особенно с учетом низкой эффективности противовирусных препаратов на тот момент. Появление более действенных методов лечения породило сомнения в целесообразности выполнения биопсии, при которой возможны осложнения и диагностические ошибки.
Наблюдения за естественным течением инфекции показывают, что у 55-85% больных, перенесших острый вирусный гепатит С, вирус не элиминируется из организма. У 5-25% из них через 25-30 лет может развиться цирроз печени. Указанные данные, по-видимому, несколько завышены, так как отражают в основном статистику специализированных клиник (ошибка из-за различий в критериях отбора пациентов). Цирроз печени, развивающийся вследствие вирусного гепатита С, может привести к дальнейшему возникновению печеночной недостаточности (риск составляет около 30% в течение 10 лет) и ГЦК (риск около 1-3% в год). Спонтанное выздоровление при остром вирусном гепатите С чаще наблюдается у детей и молодых женщин, нежели у лиц старшего возраста. Излечившиеся от острого вирусного гепатита С (те 15-45%, у которых вирусная РНК в сыворотке крови не определяется) не подвержены поздним осложнениям, и лечение им не требуется. Однако острую инфекцию выявляют редко, и у большинства пациентов обнаруживают уже хронический вирусный гепаит С. Хроническая HCV-инфекция имеет значение не только для самих инфицированных, но и для тех, кто с ними контактирует: у первых сохраняется риск прогрессирования заболевания до цирроза и/или ГЦК, для вторых существует риск инфицирования HCV. В проспективных исследованиях с участием детей и женщин, инфицированных HCV в молодом возрасте и наблюдавшихся в течение 20-30 лет, были получены данные о низкой частоте развития цирроза — от 1 до 3%. Тем не менее при хроническом вирусном гепатите С главную опасность представляет цирроз печени, к факторам риска которого относятся инфицирование в старшем возрасте (особенно у мужчин), ожирение или жировая дистрофия печени, сопутствующая ВИЧ-инфекция, а также ежедневное употребление более 50 мл алкоголя, хотя точное количество алкоголя, ведущее к прогрессированию фиброза, до сих пор неизвестно.
Цель лечения — избежать осложнений гепатита С, что наиболее вероятно при элиминации вируса. В связи с медленным (в течение нескольких десятилетий) развитием HCV-инфекции продемонстрировать влияние терапии на осложнения заболевания печени непросто. Поэтому ответ на терапию определяется на основании суррогатных вирусологических параметров, а не клинических конечных точек. Краткосрочные результаты могут быть определены с помощью биохимических (нормализация активности сывороточной АЛТ), вирусологических (отсутствие РНК HCV в сыворотке крови по данным ПЦР) и гистологических (уменьшение степени некровоспалительной активности <2 баллов при отсутствии утяжеления степени фиброза) методов. Вирусный гепатит С считается излеченным, если достигается устойчивый вирусологический ответ (УВО), то есть после завершения противовирусной терапии качественный анализ на вирусную РНК остается отрицательным. Такая ситуация в общем рассматривается как «вирусологическое излечение», хотя зафиксированы случаи обнаружения рака печени годы спустя, особенно если имелся цирроз на момент достижения УВО. Быстрый вирусологический ответ (БВО) определяется как отсутствие РНК HCV в сыворотке крови на 4-й неделе терапии по данным ПЦР с нижним порогом чувствительности 50 МЕ/мл, и он является предиктором высокой вероятности достижения УВО. Основным предиктором излечения служит ранний вирусологический ответ (РВО) — снижение концентрации вирусной РНК в 100 раз или исчезновение вируса из крови на 12-й неделе терапии. Отсутствие развития РВО, в свою очередь, является наиболее достоверным предиктором отсутствия возможности достижения УВО. Если отрицательный результат анализа на вирусную РНК зафиксирован по завершении 24- или 48 (72)-недельного курса терапии, говорят о вирусологическом ответе на лечение (ВОЛ). Когда вирусная РНК вновь появляется после отмены препаратов, то считается, что у больного рецидив. Если в ходе лечения концентрация HCV остается неизменной, говорят об отсутствии ответа на лечение; если виремия снижается, но вирус продолжает определяться в крови, — о частичном ответе на лечение. У пациентов, прошедших курс лечения (особенно у достигших УВО), улучшается гистологическая картина печени и уменьшается выраженность фиброза.
В лечении вирусного гепатита С достигнуты значительные успехи. В рандомизированных клинических исследованиях наибольшая частота УВО была получена при использовании двух препаратов: пегилированных интерферонов длительного действия — пегинтерферонов, вводимых подкожно (п/к) 1 раз в неделю, в сочетании с приемом рибавирина внутрь. В настоящее время несколько схем терапии, разработанных на основе указанной комбинации препаратов, признаны в качестве стандарта лечения вирусного гепатита С (табл. 1).
|
Препарат |
Рекомендуемая доза |
|
Комбинация пегинтерферона с рибавирином |
|
|
Пегинтерферон альфа-2а |
180 мкг/нед п/к, независимо от массы тела |
|
Пегинтерферон альфа-2b |
1,5 мкг/кг в неделю п/к |
|
Рибавирин |
800-1400 мг/сут внутрь (в 2 приема), доза зависит от генотипа вируса и массы тела пациента |
|
Схемы, применяемые в некоторых клинических ситуациях |
|
|
Пегинтерферон альфа-2а в виде монотерапии |
180 мкг/нед п/к, независимо от массы тела |
|
Пегинтерферон альфа-2b в виде монотерапии |
1,0 мкг/кг в неделю п/к |
|
Интерферон альфа-2b + рибавирин |
Интерферон альфа-2b — 3 млн МЕ п/к 3 раза в неделю. Рибавирин —1000 мг/сут (при массе тела <75 кг) или 1200 мг/сут (при массе тела >75 кг) внутрь (в 2 приема) |
Выбор данных схем терапии основан на результатах ключевых рандомизированных клинических исследований, в которых было показано, что введение препаратов пегинтерферона 1 раз в неделю в сочетании с рибавирином (внутрь дважды в сутки) приводит к излечению чаще, чем введение интерферона альфа 3 раза в неделю в сочетании с рибавирином или введение одного пегинтерферона (табл. 2).
|
Препарат |
В целом |
1-й генотип HCV |
1-й генотип HCV + высокая вирусная нагрузка |
2-й или 3-й генотип |
|
Пегинтерферон альфа-2а + рибавирин |
56 |
46 |
41 |
76 |
|
Пегинтерферон альфа-2а + рибавирин |
63 |
52 |
47 |
84 |
|
Пегинтерферон альфа-2b + рибавирин |
54 |
42 |
30 |
82 |
|
Пегинтерферон альфа-2b + рибавирин* |
61 |
48 |
37 |
88 |
|
* - Вторичный анализ при дозе рибавирина > 10,6 мг/кг |
||||
Несмотря на то, что результаты указанных исследований невозможно сравнить напрямую, эти исследования определили несколько ключевых компонентов терапии, а именно надлежащие дозы препаратов, оптимальную длительность терапии и необходимость различных подходов для лечения пациентов с 1-м и 4-м, а также со 2-м и 3-м генотипами HCV.
|
Лечение вирусного гепатита С, вызванного HCV 1-го и 4-го типа
|
|
Лечение вирусного гепатита С, вызванного HCV 2-го и 3-го типа
|
Пегилированные интерфероны получают путем присоединения к интерферонам инертного полимера полиэтиленгликоля (ПЭГ), в результате чего уменьшается почечный клиренс и увеличивается период полувыведения препарата. В настоящее время разрешены к применению два препарата пегилированных интерферонов — пегинтерферон альфа-2b, имеющий линейную молекулу ПЭГ молекулярной массой 12 кДа, ковалентно связанную с молекулой стандартного интерферона альфа-2b, и пегинтерферон альфа-2а, имеющий разветвленную молекулу ПЭГ молекулярной массой 40 кДа, ковалентно связанную с молекулой стандартного интерферона альфа-2а. Дозирование этих двух форм пегилированного интерферона различно.
Оптимальной дозой пегинтерферона альфа-2b является доза 1,5 мкг/кг в неделю, рассчитываемая в соответствии с массой тела пациента. Несмотря на то, что доза рибавирина, использовавшаяся в оригинальном регистрационном исследовании, была фиксированной и составляла 800 мг/сут, последующее исследование пациентов инфицированных 1-м генотипом HCV продемонстрировало, что дозирование рибавирина по массе тела (800 мг для пациентов с массой тела <65 кг, 1000 мг для пациентов с массой тела 65-85 кг, 1200 мг для пациентов с массой тела 85-105 кг и 1400 мг для пациентов с массой тела >105 кг) более эффективно.
Пегинтерферон альфа-2а назначается в фиксированной дозе 180 мкг/нед, вводимой подкожно, в комбинации с рибавирином в дозе от 1000 до 1200 мг/сут (1000 мг для пациентов с массой тела <75 кг, 1200 мг для пациентов с массой тела >75 кг). В регистрационном исследовании было выявлено два полезных эффекта, возникающих при сочетанном применении рибавирина: увеличение частоты ВОЛ и, что еще более важно, значительное снижение частоты рецидивов по сравнению с монотерапией пегинтерфероном.
Еще одно рандомизированное исследование позволило установить, что выбор оптимальной длительности терапии должен быть основан на генотипе вируса. В этом исследовании было показано, что пациенты, инфицированные 1-м генотипом HCV, должны получать терапию пегинтерфероном альфа-2а и рибавирином, дозированным по массе тела, в течение 48 нед, в то время как для пациентов, инфицированных 2-м и 3-м генотипами HCV, достаточно получать терапию пегинтерфероном альфа-2а и рибавирином в низкой дозе (800 мг) в течение 24 нед.
Препарат рибавирин, входящий в состав всех современных схем противовирусной терапии вирусного гепатита С, заслуживает особого внимания. Рибавирин синтезирован в 1972 г. и является водорастворимым нуклеозидом — упрощенным аналогом гуанозина, лишенным пиримидинового кольца. Спектр его противовирусной активности invitro необычайно широк. Рибавирин ингибирует репликацию более 12 видов ДНК- и 30 видов РНК-геномных вирусов (респираторносинцитиального вируса, ВИЧ, вирусов гриппа А и В, парагриппа, герпес-вирусов, лихорадки Ласса, геморрагической лихорадки с почечным синдромом, кори и многих других). Широкий спектр его активности свидетельствует о том, что рибавирин, также как и интерферон, является средством неспецифической этиотропной противовирусной терапии. Согласно современным представлениям, рибавирин в режиме монотерапии недостаточно эффективен при лечении больных с хроническим вирусным гепатитом С. В 1996 г. Dusheiko G. et al. было показано, что применение рибавирина в течение 24 нед в стандартной дозе хотя и приводит к снижению активности АЛТ, но влияния на уровень вирусной нагрузки и степень выраженности патологического процесса в печени не оказывает. Из-за отсутствия вирусологического ответа при лечении хронического вирусного гепатита С попытки монотерапии рибавирином были прекращены. В то же время пилотные исследования показали, что сочетание рибавирина с интерфероном приводит к значительному улучшению результатов терапии. Причина такого синергизма до настоящего времени до конца не выяснена. Считается, что активной формой рибавирина является рибавирин-монофосфат, который ингибирует инозин монофосфат-дигидрогеназу, что способствует уменьшению внутриклеточного пула гуанозинтрифосфата (ГТФ). Дефицит ГТФ приводит к тому, что синтезируется молекулы РНК с аномальными 5'-концами. Не исключено, что рибавирин оказывает прямое ингибирующее действие на вирусную РНК-полимеразу. В своем исследовании V. Meier et al. показали, что рибавирин не только влияет на синтез вирусных частиц гепатоцитами, но и (за счет подавления синтеза нуклеиновых кислот и белка) снижает синтез провоспалительных цитокинов (в частности, интерферона гамма), а также индуцирует апоптоз инфицированных клеток. Поэтому в настоящее время рибавирин применяется для лечения хронического гепатита С только в комбинации с препаратами интерферона.
Для определения длительности лечения и выяснения оптимальной дозы рибавирина было выполнено кооперированное рандомизированное контролируемое исследование. Все участники исследования получали пегинтерферон альфа-2а в дозе 180 мкг в четырех разных комбинациях с рибавирином. Комбинации различались либо дозой рибавирина — 800 мг/сут в сравнении с 1000 или 1200 мг/сут (в зависимости от массы тела), либо длительностью лечения — 24 нед в сравнении с 48 нед. Результаты анализировали с учетом генотипа вируса: у пациентов, инфицированных 1-м генотипом HCV, принимали во внимание уровень исходной вирусной нагрузки (выше или ниже 2-106 копий/мл). При HCV- инфекции, вызванной 1-м генотипом, и низкой исходной вирусной нагрузке частота УВО была максимальной у пациентов, получавших высокую дозу рибавирина в течение 48 нед, и составила 61% (рисунок 1).
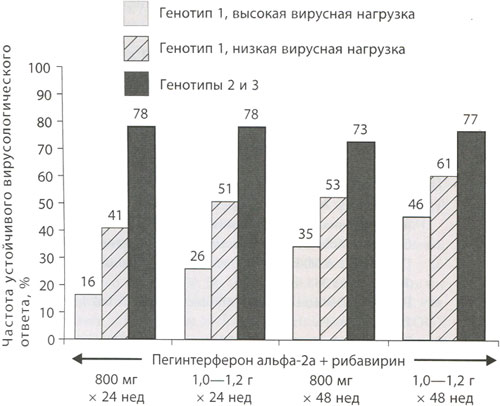
Рис. 1. Частота устойчивого вирусологического ответа при терапии пегинтерфероном альфа-2а и рибавирином в зависимости от дозы рибавирина и длительности терапии.
ПЕГ – пегинтерферон
РБ - рибавирин
Эта схема оказалась оптимальной и при высокой исходной вирусной нагрузке: частота УВО составила 46%. Напротив, у инфицированных 2-м или 3-м генотипом HCV независимо от исходной вирусной нагрузки результаты лечения в разных группах практически не различались. Следовательно, при инфекции, вызванной 2-м или 3-м генотипом HCV, рибавирин можно назначать в дозе 800 мг в течение 24 нед.
Недавно были опубликованы результаты исследования, в котором изучали влияние снижения дозы рибавирина, используемого в комбинации с пегинтерфероном альфа-2b, на частоту возникновения вирусологического рецидива у пациентов с хроническим вирусным гепатитом С, инфицированных 1-м генотипом HCV. Результаты исследования показали, что пошаговое снижение дозы рибавирина было ассоциировано со ступенчатым повышением частоты вирусологических рецидивов от 11 до 60%. При анализе пациентов с РВО, у которых после 12 нед лечения вирусную РНК не обнаруживали, было выявлено, что только у 4% пациентов, получавших рибавирин в дозе 12 мг/кг в сутки или более, были отмечены рецидивы. Доза рибавирина также имела значение и после 12-й недели терапии. В то же время снижение дозы пегинтерферона альфа-2b до 0,6 мкг/кг в неделю после 12 нед не привело к существенному повышению риска возникновения рецидива. Анализ 472 пациентов, у которых было обнаружено наличие вирусной нагрузки на 24-й и на 48-й неделе, показал, что факторами, в значительной степени связанными с вирусологическими рецидивами, были: степень фиброза (Р=0,002), время до исчезновения РНК HCV в организме (Р<0,001), средние дозы рибавирина (Р<0,001). При этом дозы пегинтерферона альфа- 2b не оказывали значимого влияния на прогноз в отношении возникновения рецидивов. Основываясь на этих данных, авторы исследования заключили, что сохранение высоких доз рибавирина (больших или равных 12 мг/кг в сутки) в течение всего периода терапии может привести к подавлению рецидивов у пациентов, инфицированных 1-м генотипом HCV. При сохранении адекватной дозы рибавирина доза интерферона может быть безопасно снижена после 12 нед без повышения риска несостоятельности лечения.
Частота и характер побочных эффектов при лечении препаратами пегинтерферонов и рибавирином сходны с таковыми при назначении интерферона в комбинации с рибавирином. Примерно у 75% больных отмечают один или несколько побочных эффектов.
Побочные эффекты, свойственные препаратам интерферона: нейтропения, тромбоцитопения, депрессия, гипотиреоз и гипертиреоз, раздражительность, нарушение памяти и концентрации внимания, нарушение зрения, утомляемость, боль в мышцах, головная боль, тошнота и рвота, раздражение кожи, субфебрильная температура, похудание, бессонница, ухудшение слуха, шум в ушах, интерстициальный фиброз, алопеция. При лечении пегинтерфероном альфа-2а гриппоподобный синдром и депрессия возникали реже, чем при использовании интерферона альфа-2b.
Побочные эффекты, свойственные рибавирину: гемолитическая анемия, утомляемость, зуд, сыпь, синуситы, подагра. Кроме того, из-за тератогенного действия рибавирина женщинам фертильного возраста необходимо пользоваться надежными методами контрацепции не только во время лечения, но и в течение 6 мес после его отмены.
Побочные эффекты обычно сильнее выражены в первые недели лечения и нередко купируются с помощью анальгетиков, например парацетамола (до 2,0 г/сут), нестероидных противовоспалительных препаратов, антидепрессантов (например, ингибиторов обратного захвата серотонина) и, изредка, препаратов колониестимулирующих факторов.
В настоящее время основными трудностями терапии, в отношении которых необходима разработка новых подходов, направленных на увеличение частоты УВО, являются:
Прогностические факторы ответа используются для определения вероятности достижения УВО пациентом. На сегодняшний день выявлены два основных предиктора УВО: генотип вируса и исходная вирусная нагрузка. Частота УВО была выше у пациентов, инфицированных не 1-м генотипом HCV (в основном 2-м и 3-м генотипами), а также у тех, у кого вирусная нагрузка до начала терапии была ниже 600 тыс. МЕ/мл. К другим, менее строго доказанным исходным показателям благоприятного ответа, можно отнести: дозы пегинтерферонов (1,5 мкг/кг в неделю по сравнению с 0,5 мкг/кг в неделю) и рибавирина (>10,6 мг/кг), женский пол, возраст <40 лет, не негроидную расу, массу тела <75 кг, отсутствие резистентности к инсулину и повышенного уровня АЛТ (в 3 раза выше нормы), а также отсутствие мостовидного фиброза и цирроза по результатам биопсии печени.
Тактика клинического ведения пациентов в случаях отсутствия эффективности при первичном лечении зависит от ряда факторов: противовирусной активности использованной терапевтической схемы, свойств возбудителя и особенностей пациента.
В большинстве случаев возможны два неблагоприятных исхода — отсутствие ответа на лечение и рецидив. Примерно у 30% пациентов, получавших препараты пегилированного интерферона вместе с рибавирином, не удается добиться элиминации вируса из организма. Повторное лечение с использованием такой же схемы, как правило, приводит к УВО менее чем в 5% случаев, поэтому не может быть рекомендовано. В то же время повторное лечение с использованием препаратов пегинтерферона и рибавирина позволяет добиться успеха у 25-40% пациентов, резистентных к монотерапии интерфероном альфа, и приблизительно у 10% больных, резистентных к интерферону альфа в сочетании с рибавирином. При этом УВО можно добиться только в том случае, если у пациента был частичный ответ на первичное лечение. При полном отсутствии ответа на первичное лечение повторная терапия тоже, как правило, оказывается неэффективной. Вероятность успеха повторного лечения повышают следующие факторы:
Лечение вирусологического рецидива в основном бывает успешным. Если рецидив возник после монотерапии интерфероном, при повторном лечении интерфероном и рибавирином в течение 24 нед частота УВО может доходить до 50%. В случае рецидива благоприятными прогностическими факторами оказываются наличие у пациента HCV-инфекции с 2-м или 3-м генотипом, а также низкая исходная вирусная нагрузка. Для оценки терапии вирусологического рецидива после лечения стандартным интерфероном и рибавирином было выполнено исследование, в котором использовали высокие дозы пегинтерферона альфа-2b — 1,5 мкг/кг в неделю с фиксированной дозой рибавирина — 800 мг/сут и низкие дозы пегинтерферона альфа-2а — 1 мкг/кг в неделю в сочетании с дозированным в зависимости от массы тела рибавирином — от 1000 до 1200 мг/сут. Общий показатель УВО составил 42%, и хотя он был выше в группе, получавшей более высокие дозы пегинтерферона (50%), чем в группе, получавшей более низкие дозы (32%), количество пациентов было слишком малым для того, чтобы сделать убедительные выводы.
При хроническом вирусном гепатите С назначают также поддерживающую терапию препаратами пегинтерферонов, прежде всего с целью устранить виремию. В последние годы накапливается все больше данных о том, что ликвидация виремии оказывается не единственным благоприятным последствием поддерживающей терапии. Даже при сохранении виремии поддерживающая терапия может улучшить гистологическую картину печени, а в ряде случаев замедлить или предотвратить развитие цирроза и снизить риск развития ГЦК. Оценку эффективности поддерживающей терапии препаратами пегинтерферона с целью замедления или предотвращения развития цирроза и/или печеночной недостаточности проводили в нескольких рандомизированных исследованиях, выполненных в США и Европе. Однако данные все еще остаются противоречивыми. Относительно недавно были опубликованы результаты исследования HALT-C. В этом исследовании, несмотря на то, что сывороточные уровни АЛТ, РНК HCV и степень некровоспалительной активности снизились в процессе лечения у большинства пациентов, показатели клинической декомпенсации и гистологического прогрессирования цирроза остались практически одинаковыми как в группе, получавшей терапию, так и в группе контроля (34,1% и 33,8% соответственно). Таким образом, результаты исследования HALT-C свидетельствуют о том, что поддерживающая терапия пегинтерфероном альфа-2а с использованием низких доз (90 мкг/нед) не показана пациентам с вирусным гепатитом С, имеющим мостовидный фиброз или цирроз печени, у которых ответ на терапию стандартным курсом пегинтерферона и рибавирина отсутствовал. Тем не менее повторная терапия препаратами пегинтерферона и рибавирином при отсутствии ответа на лечение или при рецидиве показана пациентам с выраженным фиброзом или циррозом печени, ранее получавшим обычный интерферон. В тоже время необходимо учитывать, что повторная терапия препаратами пегинтерферона и рибавирином при отсутствии ответа на лечение или при рецидиве не показана лицам, ранее получавшим пегинтерферон и рибавирин, даже если предполагается использовать другой препарат пегинтерферона.
Методы диагностики и терапии вирусного гепатита С постоянно совершенствуются. Появление новых результатов клинических исследований неизбежно приведет к расширению наших представлений относительно патогенеза HCV-инфекции, и, следовательно, к пересмотру некоторых утвержденных на сегодняшний день диагностических и терапевтических подходов. А использование в клинической практике таких параметров, как генотип HCV, исходная виремия и ее динамика, в ходе лечения, вероятно, позволят в большей степени индивидуализировать противовирусную терапию в целях достижения УВО и излечения HCV-инфицированных лиц от этого опасного заболевания.
Специалисты утверждают, что каждая женщина хотя бы раз в жизни сталкивается с гинекологическим...
Согласно данным всеукраинских общественных организаций, в Украине насчитывается примерно 5...
Сердечно-сосудистые заболевания, несмотря на достижения современной кардиологии, остаются...
Определение тактики ведения пациента, в том числе выбор (осуществляемый по важнейшим...
Хронический гепатит — это хронический воспалительный процесс в печени, который длится на...
анализы, БАД, биологическая медицина, витамины, гастроэнтерология, гигиена, гинекология, гомеопатия, дерматология, диагностика, диетология, заболевания, иммунология, инфекционные заболевания, инфекция, исследования, кардиология, кожа, косметика, красота, лекарственные растения, лечение, лицо, неврология, обследование, оздоровление, онкология, ортопедия, педиатрия, питание, пищеварительная система, поведение, похудение, препараты, продукты, профилактика, процедура, психология, пульмонология, рак, реабилитация, сердечно-сосудистая система, ССС, тело, терапия, травматология, уход, фитотерапия, хирургия, эндокринология
Показать все теги

Комменатрии к новости