Вкусно есть и долго жить
Эффективное пищеварение – основа жизненных процессов. В условиях нарушенного пищеварения...
Специалистам / Практика / Практика (статья)
 ПанкреатитПроблема хронического панкреатита (ХП) — одна из самых сложных в гастроэнтерологии и хирургии. Темпы роста частоты патологии поджелудочной железы (ПЖ) — одни из самых высоких во многих странах мира. Наиболее распространенный этиологический фактор хронического панкреатита — злоупотребление алкоголем. Однако, существует и целый ряд других причин развития заболевания. Один из самых сложных для лечения вариантов хронического панкреатита — постгастрорезекционный панкреатит. Хронический панкеатит и панкреатическая недостаточность развиваются и после других хирургических вмешательств на органах пищеварения: после резекции поджелудочной железы, тонкой кишки, холецистэктомии.
ПанкреатитПроблема хронического панкреатита (ХП) — одна из самых сложных в гастроэнтерологии и хирургии. Темпы роста частоты патологии поджелудочной железы (ПЖ) — одни из самых высоких во многих странах мира. Наиболее распространенный этиологический фактор хронического панкреатита — злоупотребление алкоголем. Однако, существует и целый ряд других причин развития заболевания. Один из самых сложных для лечения вариантов хронического панкреатита — постгастрорезекционный панкреатит. Хронический панкеатит и панкреатическая недостаточность развиваются и после других хирургических вмешательств на органах пищеварения: после резекции поджелудочной железы, тонкой кишки, холецистэктомии.
Особое место в отношении тяжести панкреатической недостаточности занимают состояния после резекции поджелудочной железы по поводу различных заболеваний. Степень функциональной недостаточности поджелудочной железы у таких больных зависит от объема резекции, полноценности дренирования панкреатического секрета в тонкую кишку, типа анастомоза между протоком поджелудочной железы и просветом пищеварительного тракта. После резекции поджелудочной железы «включается» целый ряд патогенетических механизмов. Вообще, экзокринная функция поджелудочной железы остается более сохранной после дренирующих операций, чем после резекции. Это объясняется тем, что после любой резекции поджелудочной железы объем остаточной паренхимы органа меньше, чем после дренирующих вмешательств. Важными факторами, определяющими реализацию активности панкреатических ферментов, являются состояние тонкокишечного транзита и моторика тонкой кишки. Панкреатоеюнальный анастомоз в отношении реализации внешнесекреторной функции поджелудочной железы имеет преимущества перед панкреатикогастральным анастомозом в случаях резекции головки железы. При органосохраняющих (дуоденумсохраняющих, пило- росохраняющих) резекциях головки поджелудочной железы, которые в настоящее время стали стандартом, моторика тонкой кишки страдает мало. Исключением являются операции, при которых проводят широкое удаление лимфоузлов (операции по поводу рака поджелудочной железы). С другой стороны, длина отводящей петли для дренирования панкреатического протока (например, при продольной панкреатоеюностомии), а также то, была ли использована первая или вторая петля тощей кишки, существенно влияет на эффективность действия собственных панкреатических ферментов. Как уже было сказано выше, кроме адекватного количества ферментов имеет значение место их поступления в пищеварительную трубку. Оптимальным для гидролиза жиров является поступление ферментов в двенадцатиперстную кишку или в начальные отделы тощей кишки. После панкреатогастростомии, которая сравнительно редко выполняется в Европе, экзокринная функция поджелудочной железы обычно ниже, чем после панкреатоеюностомии.
Пациенты, которые перенесли ятрогенную окклюзию панкреатического протока при операции Каухи-Уиппла (в настоящее время не применяется), независимо от объема резекции нуждаются в заместительной ферментной терапии.
После любого варианта резекции поджелудочной железы абсорбция нутриентов снижена в течение первых нескольких месяцев. Пациенты набирают вес медленно, но потеря веса после оперативного вмешательства должна быть компенсирована максимум в течение шести месяцев. В некоторых случаях возможно даже улучшение внешнесекреторной функции поджелудочной железы по сравнению с предоперационным состоянием.
Показано, что больные с нормальной панкреатической секрецией до операции с большей вероятностью сохраняют нормальную внешнесекреторную функцию поджелудочной железы и после вмешательства, в отличие от пациентов, которые еще до операции имели снижение панкреатической секреции. В последнем случае восстановление нормальной продукции ферментов поджелудочной железы менее вероятно. В одном небольшом исследовании, в которое вошли 15 больных, показано, что пациенты после тотальной панкреатэктомии восстанавливаются быстрее, если они получают достаточное количество жиров. Необходимы так же достаточные дозы витамина D.
В одном из исследований, проведенных в Финляндии, с помощью магнитно-резонансной томографии / магнитно-резонансной холангиопанкреатографии продемонстрировано, что у значительной части больных панкреатическая недостаточность после резекции поджелудочной железы может быть связана со стенозом анастомоза. Если у пациента есть подозрение на такой стеноз, то необходимо провести эндоскопическую ретроградную холангиопанкреатографию, а при необходимости выполнить двойную баллонную эндоскопию.
В нескольких исследованиях показано, что после резекции поджелудочной железы возможно расхождение между клиническими симптомами и степенью стеатореи. Хотя некоторые больные нуждаются в сотнях тысяч единиц липазы в составе ферментных препаратов (ФП). В отдаленные сроки после резекции поджелудочной железы могут развиваться состояния, связанные с дефицитом жирорастворимых витаминов и микроэлементов.
В одном из исследований с длительным наблюдением за больными 65% пациентов, перенесших резекцию поджелудочной железы по поводу хронического панкреатита, имели после операции внешнесекреторную панкреатическую недостаточность: у половины из них эта недостаточность развилась или усугубилась после хирургического вмешательства (в течение десятилетнего периода наблюдения).
Для диагностики и оценки степени панкреатической недостаточности после оперативных вмешательств на поджелудочной железе целесообразно использовать триглицеридный дыхательный тест.
Прогностическим фактором развития экзокринной недостаточности поджелудочной железы после оперативного вмешательства является выраженный фиброз в удаленной ткани железы.
Если принимать во внимание то, что, например, в России ежегодно производится более 30 тыс. резекций желудка, число людей, страдающих различными пострезекционными нарушениями, значительно. Поэтому изучение вопросов патогенеза патологических синдромов после резекции желудка, разработка мер их профилактики и лечения, имеет большое социальное и экономическое значение.
Операция резекции желудка создает новые топографо-анатомические взаимоотношения в верхнем отделе пищеварительного тракта, разрушает уже слаженный в онто- и филогенезе механизм взаиморегуляции органов пищеварения, вносит глубокие функционально-морфологические изменения в органы и системы, прямо или косвенно связанные с процессом пищеварения.
Кроме расстройств взаимосвязей органов пищеварения, к причинам постгастрорезекционных синдромов относят недостаточное обследование больных перед плановыми первичными операциями, в связи с чем у пациентов не диагностируют уже имеющиеся заболевания и состояния. В частности, нередко у больных не диагностируют хронический панкреатит, билиарную патологию. Причиной постгастрорезекционных синдромов могут быть и технические погрешности, допущенные во время выполнения оперативных вмешательств (экономная резекция желудка может способствовать сохранению повышенной кислотопродукции и привести к рецидиву язвы или к образованию пептической язвы анастомоза: наложение слишком широкого гастроэнтероанастомоза способствует быстрому сбросу из культи желудка в отводящую петлю; недостаточная коррекция замыкательного аппарата кардии приводит к рецидиву рефлюкс-эзофагита и развитию пептической стриктуры пищевода и т. д.). Эти причины являются основанием для формирования нарушений эвакуации из желудка: чаще к ускорению этой эвакуации с развитием демпинг-синдрома, но в ряде случаев — к гастростазу.
В патогенезе постгастрорезекционных синдромов выделяют три главных механизма: нарушение характера и сроков эвакуации желудочного содержимого в кишечник — т. н. нарушение пищеварительного графика; дуоденогастральный или энтерогастральный рефлюксы; прогрессирование в послеоперационном периоде хронических нарушений дуоденальной проходимости. В соответствии с этим все постгастрорезекционные синдромы разделяют на органические и функциональные. К органическим синдромам относят: пептическую болезнь оперированного желудка (пептическая язва анастомоза тощей кишки, рецидивная язва, незажившая язва); рак культи желудка; рубцовое сужение гастроэнтероанастомоза; желудочно-кишечные, желудочно-билиарные, еюно-ободочные свищи; синдром приводящей петли; порочный круг; осложнения вследствие нарушения методики операций; каскадную деформация желудка; постгастрорезекционный хронический панкреатит. Выделяют следующие функциональные постгастрорезекционные синдромы: демпинг-синдром; гипо/гипергликемический синдром; энтерогенный синдром; функциональный синдром приводящей петли; постгастрорезекционную анемию; постгастрорезекционную астению; гастростаз; диарею; дисфагию; щелочной рефлюкс-гастрит.
Высока частота развития дисфункции желчного пузыря и сфинктера Одди после проведения резекции желудка. Так, по данным Г. К. Жерлова с соавт. резекция желудка приводит к нарушению сократительной и резервуарной функций желчного пузыря более, чем у 80,0% оперированных больных. Это объясняют тем, что после резекции желудка с выключением из пассажа двенадцатиперстной кишки снижается выработка холецистокинина и мотилина, что и приводит к дисмоторным нарушениям со стороны желчного пузыря, застою желчи в нем и повышению литогенных свойств желчи. Такие изменения чаще возникают после резекции желудка по Бильрот-2. У пациентов увеличиваются объем желчного пузыря и продолжительность его сокращения, а также количество остаточной желчи. При этом характерно повышение тонуса сфинктера Одди по результатам исследования уроамилазы мочи. После операции по Бильрот-1, напротив, длительное время сохраняется гиперкинезия желчного пузыря. При одновременном выполнении ваготомии вероятность дисфункции желчного пузыря и сфинктера Одди значительно повышается. В отдаленные сроки после резекции желудка повышается литогенность желчи: у больных возникают изменения физико-химических и биохимических свойств желчи, появляются кристаллы кальция билирубината, снижается содержание в желчи фосфолипидов и желчных кислот (изменяется время нуклеации). В связи с гипокинетически-гипотонической дисфункцией желчного пузыря и повышением литогенности желчи значительно повышается риск развития желчнокаменной болезни. Так, через 1 мес. и 3 мес. после оперативного вмешательства частота образования камней в желчном пузыре составляет соответственно 13,6% и 18,2%. Через 3 мес. после резекции желудка по Гофмейстеру-Финстереру частота камнеобразования достигает 28,6%. Это повышает необходимость повторных оперативных вмешательств, с одной стороны, и риск развития постгастрорезекционного хронического панкреатита, с другой стороны, т. к. желчнокаменная болезнь — один из основных этиологических факторов ХП. В патогенезе постгастрорезекционного хронического панкреатита участвует также дисфункция сфинктера Одди, которая может быть причиной не только постгастрорезекционного хронического панкреатита, но и острого послеоперационного панкреатита. В этом отношении опасна механическая травматизация и в дальнейшем рубцовая деформация большого дуоденального сосочка.
Среди способствующих факторов в развитии панкреатита прежде всего выделяют операционную травму при резекции желудка, приводящую к временному нарушению кровообращения поджелудочной железы.
Важное значение в развитии хронического панкреатита имеет перераспределение микрофлоры кишки, приводящее к инфицированию двенадцатиперстной кишки микрофлорой из нижележащих отделов кишки. В последующем инфекция попадает в панкреатические протоки. Повышение давления в приводящей петле, что бывает нередко, приводит к возникновению дуодено-панкреатического рефлюкса с выбросом содержимого двенадцатиперстной кишки и желчи в поджелудочную железу. Повышение давления в панкреатических протоках ведет к разрыву их стенки, поступлению панкреатического сока в интерстициальную ткань железы с последующим развитием воспалительного процесса.
Кроме того, в связи с расстройством гормональной регуляции функции поджелудочной железы повышается вязкость панкреатического секрета, усугубляется дисфункция сфинктера Одди, что способствует нарушению оттока и желчи, и сока поджелудочной железы. В связи с резекцией желудка, как правило, снижается продукция гастрина, следствием него является снижение желудочной секреции и нарушение секретиновой стимуляции поджелудочной железы. Напротив, при сохранении привратника удерживается гипергастринемия и высокая желудочная секреция, что способствует рецидивированию пептической язвы и формированию язвы анастомоза. Эта ситуация неблагоприятна и в отношении повышения риска развития постга- строрезекционного хронического панкреатита из-за избыточной секретиновой стимуляции поджелудочной железы.
Т. е. патогенез постгастрорезекционного хронического панкретита многогранен, с чем связаны сложности его диагностики и лечения. Лечение больных с постгастрорезекционным хроническим панкреатитом разработано недостаточно. Для профилактики заболевания разрабатывают различные варианты реконструктивных операций.
Что касается внешнесекреторной недостаточности поджелудочной железы, то она не имеет прямой связи с резекциями желудка по Бильрот-1 или по Бильрот-2. В зависимости от особенностей проведенной операции (+/- Броуновский анастомоз) после вмешательства по Бильрот-2 могут развиться синдромы приводящей или отводящей петли. Это приводит к росту частоты мальабсорбции, причем симптомы могут быть сходны с проявлениями панкреатической недостаточности. При появлении такой клиники нередко назначают ферментные препараты, которые вначале оказываются эффективными. Однако, на самом деле, происходит только сглаживание клинических симптомов. В этих случаях при появлении абдоминальной боли, сопровождающейся диареей, метеоризмом, необходимо вначале провести диагностику перед назначением ферментных препаратов, чтобы убедиться в их целесообразности или, наоборот, нецелесообразности. Обследование должно включать сонографию, фекальный эластазный тест, водородные дыхательные тесты. Следует учитывать, что симптомы мальассимиляции могут быть вызваны и другими факторами (рис. 1): ускоренным тонкокишечным транзитом, синдромом избыточного бактериального роста, неадекватной секретиновой стимуляцией поджелудочной железы, асинхронизмом поступления в тонкую кишку химуса и панкреатических ферментов. При этом асинхронизме, который обычно развивается после резекции желудка по Бильрот-2, не происходит тесного контакта химуса с панкреатическими ферментами или этот контакт отсрочен.
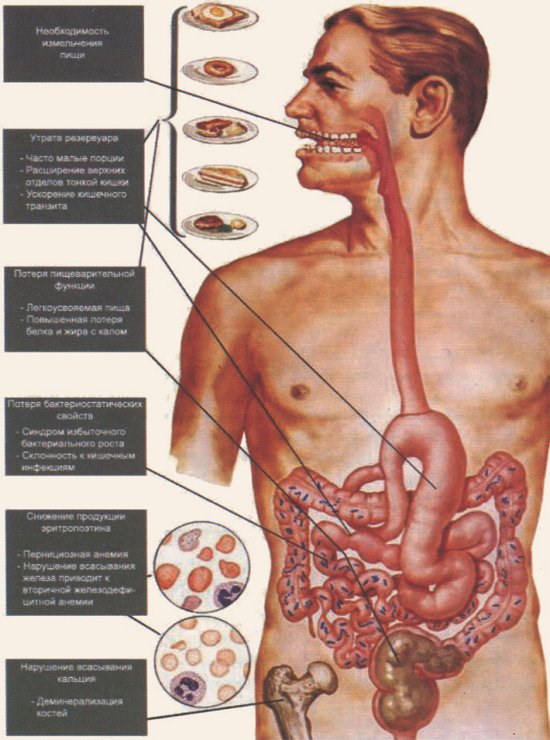 Нарушение пищеварения и симптомы мальассимиляции после гастроэктомии (по F.H. Netter, 2002)
Нарушение пищеварения и симптомы мальассимиляции после гастроэктомии (по F.H. Netter, 2002)
Рис. 1. Нарушение пищеварения и симптомы мальассимиляции после гастроэктомии (по F.H. Netter, 2002)
Что касается состояний после тотальной гастрэктомии, то в этих случаях пациенты нуждаются в ферментных препаратах хотя бы в течение первых 3-6 месяцев после операции. По поводу целесообразности и эффективности назначения заместительной ферментной терапии мультицентровые плацебо-контролируемые двойные слепые рандомизированные исследования не проводились. Выполнено лишь исследование, в рамках которого ферментные препараты назначались в течение 123 дней после оперативного вмешательства. Это означает, что мы не имеем достаточных доказательств, подтверждающих необходимость назначения ферментных препаратов после гастрэктомии. Вероятно, исключением следует считать случаи, когда развиваются нарушения моторики после расширенной лимфаденэктомии. Большинство авторов считают, что гастрэктомия не приводит к тяжелой панкреатической недостаточности, особенно при назначении раннего энтерального питания.
Если резекция тонкой кишки выполняется в комплексе с резекцией поджелудочной железы, то, конечно, происходит еще большее нарушение физиологических процессов усвоения нутриентов, а также процессов продукции гастроинтестинальных гормонов. При резекции значительной части тонкой кишки усугубляется стеаторея, так как при этом может страдать энтерогепатическая циркуляция желчных кислот. Стеаторея, в свою очередь, поддерживает диарею вследствие повышенного содержания в кишке жирных кислот. При наличии симптомов мальдигестии терапия диареи (лоперамид, холестирамин) может быть дополнена панкреатическими ферментами.
При постхолецистэктомическом синдроме (ПХЭС) еще более вероятным, чем при желчнокаменной болезни, является развитие и прогрессирование внешнесекреторной панкреатической недостаточности (рис. 2). Дело в том, что при ПХЭС «включаются» одновременно несколько, механизмов ее формирования. При дисфункции сфинктера Одди, папиллостенозе развивается асинхронизм поступления химуса и желчи в двенадцатиперстную кишку. Это является основой для хологенной панкреатической недостаточности. Из-за секреторной хологенной диареи, синдрома избыточного бактериального роста в кишечнике, формируется энтерогенная панкреатическая недостаточность. При наличии вторичного билиарного цирроза печени выраженный холестаз приводит к гепатогенной внешнесекреторной недостаточности поджелудочной железы. И, наконец, хронический билиарный панкреатит, который диагностируется у большинства больных с ПХЭС, — причина первичного снижения продукции ферментов поджелудочной железы. В итоге панкреатическая недостаточность различной степени имеет место практически во всех случаях ПХЭС.
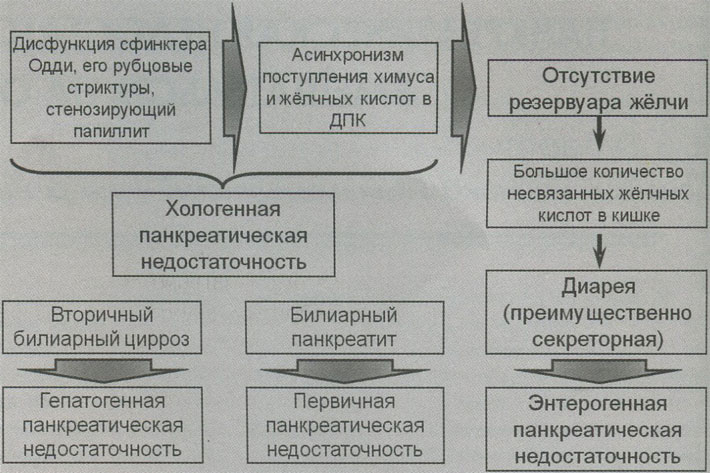
Рис. 2. Патогенез первичной и вторичной панкреатической недостаточности при постхолецистэктомическом синдроме (ПХЭС)
Вторичная гепатогенная (хологенная, билиогенная) панкреатическая недостаточность связана с дефицитом (асинхронизмом) поступления желчных кислот в двенадцатиперстную кишку, о чем было сказано выше. При этом нарушается эмульгирование жиров, и панкреатическая липаза не может их эффективно гидролизовать. Т. е., происходит усугубление мальдигестии.
Безусловно, существенное место в комплексе ПХЭС занимает и сам хронический панкреатит. Он может развиться как до холецистэктомии (вследствие желчнокаменной болезни, папиллостеноза и т. д.) и сохраняться после нее, так и после оперативного вмешательства из-за дисфункции сфинктера Одди, билио- и энтеропанкреатического рефлюксов.
Считаем важным обратить внимание на лечебное питание и особенности рациона до и после операций на поджелудочной железе. В этом отношении показательны результаты мета-анализа 10 исследований эффективности различных видов питания перед проведением обширных оперативных вмешательств по поводу хронического панкреатита. Обследован 571 пациент: 128 (22%) больным назначали полное парентеральное питание, 201 (35%) —энтеральное питание, 71 (12%) — иммунное энтеральное питание, 171 (31%) — без специального питания. Предоперационная потеря веса, уровень альбумина крови, частота желтухи были сходными во всех группах. Послеоперационное парентеральное питание приводило к увеличению частоты осложнений. Энтеральное питание в послеоперационном периоде способствовало снижению частоты инфекционных осложнений. Частое дробное регулярное энтеральное питание снижало частоту послеоперационного гастростаза. Иммунное питание не имело существенных преимуществ. Был сделан вывод, что с учетом частоты трофологической недостаточности в предоперационном периоде необходимо улучшение нутритивного статуса перед операцией.
На нутритивный статус больных хроническим панкреатитом после оперативного вмешательства существенно влияет наличие и длительность гастростаза. При гастропарезе, особенно при сахарном диабете, применяют электростимуляцию желудка, которая способствует не только ускорению пассажа пищи, но и улучшению экзокринной функции поджелудочной железы, что подтверждается результатами фекального эластазного теста.
Повышенный индекс массы тела, и, особенно, объем висцерального жира, негативно влияют на продолжительность жизни после панкреатэтомии по поводу рака поджелудочной железы.
После операции энтеральное питание имеет преимущества перед парентеральным, за исключением случаев тяжелой трофологической недостаточности.
При наличии симптомов панкреатической недостаточности в отдаленные сроки после оперативного лечения врачу следует давать пациентам диетические рекомендации, которые являются обычными при хроническом панкреатите.
Центральное место в лечении панкреатической недостаточности после операций на поджелудочной железе и других органов пищеварения занимает ферментная заместительная терапия. «Золотым стандартом» такого лечения является Креон.
Креон имеет преимущество в отношении высокой активности липазы (самая высокая активность липазы в составе Креона 40000 среди всех ферментных препаратов, зарегистрированных в странах СНГ, — 40000 ЕД FIP). Важно также наличие в арсенале врача 3 вариантов Креона, содержащих 10000, 25000 и 40000 ЕД FIP липазы. Это позволяет варьировать, выбирая вариант Креона в зависимости от степени панкреатической недостаточности у конкретного больного, комбинировать эти варианты, чтобы подобрать нужную дозу для каждого приема пищи, даже «титровать» эту дозу под контролем показателей трофологического статуса пациентов, результатов дыхательных тестов, копроскопии (лучше количественного содержания жира в кале).
Важным преимуществом и показателем сбалансированности состава всех 3 вариантов Креона является сочетание высокой активности липазы и амилазы с более низкой, хотя и достаточной для купирования панкреатической боли, активности протеаз. Так, Креон 10000 имеет 10000 ЕД FIP липазы, 8000 ЕД FIP амилазы и 600 ЕД FIP протеаз. Креон 25000 содержит 25000 ЕД FIP липазы, 18000 ЕД FIP амилазы и 1000 ЕД FIP протеаз. Креон 40000 содержит 40000 ЕД FIP липазы, 25000 ЕД FIP амилазы, 1600 ЕД FIP протеаз.
Ферментные препараты считают эффективным, если соотношение колипаза/липаза выше единицы, т. к. дефицит колипазы (кофактора липазы) приводит к снижению активности самой липазы. Эталоном в этом отношении является Креон, в котором соотношение колипаза/липаза = 1,9. В липолитическую активность ферментных препаратов вносят свой вклад карбоксилэстерлипаза и фосфолипаза А2. Креон — препарат с высоким содержанием последних двух ферментов.
Чрезвычайно важна форма выпуска ферментных препаратов для заместительной терапии. Необходимо, чтобы препарат был двухоболочечным. При этом капсула Креона, содержащая минимикросферы, растворяется в кислой среде и высвобождает эти минимикросферы уже в полости желудка. Этим обеспечивается хорошее смешивание с химусом уже в желудке. Принципиален малый размер минимикросфер, т. к. необходима их беспрепятственная эвакуация из желудка вместе с химусом. Кроме того, крохотный диаметр минимикросфер Креона обеспечивает большую площадь соприкосновения панкреатина с химусом, причем эта площадь в десятки раз больше, чем у таблетированных ферментных препаратов, и существенно больше, чем у микросферических препаратов.
Очень важно, что каждая минимикросфера Креона имеет кислотоустойчивую оболочку, которая растворяется только при рН=6,0, что характерно для дуоденального просвета.
Проведено большое количество высокодоказательных исследований, подтверждающих эффективность и безопасность Креона у больных с тяжелой панкреатической недостаточностью, в т.ч. после оперативных вмешательств на поджелудочной железе. Приведем результаты последнего из этих исследований, уровень доказательности которого наивысший (А).
Исследование было проведено для изучения эффективности и безопасности новой формы выпуска панкреатической липазы в капсулах с медленным высвобождением, содержащих 12000 USP (United States Pharmacopoeia) липазы, это соответствует 12000 ЕД FIP у пациентов с внешнесекреторной панкреатической недостаточностью, развившейся вследствие хронического панкреатита или перенесенных хирургических вмешательств на поджелудочной железе.
Это было двойное слепое, рандомизированное, плацебо-контролируемое исследование с двумя параллельными группами, которое проводилось в США, Восточной и Центральной Европе с апреля 2007 г. по август 2008 г. (clinicaltrials.gov NCT00414908).
- Больные, возрастом 18 лет и старше, подписавшие письменное информированное согласие, которых включали в исследование при наличии подтвержденного диагноза хронического панкреатита или после проведения тотальной / частичной панкреатэктомии более чем за 180 дней до включения, и доказанной внешнесекреторной панкреатической недостаточностью (согласно показателям секретинового теста или при снижении фекальной эластазы ниже 100 мкг/г, или при содержании жира в кале более 15 г/ день (исследовали показатель в кале, собранном за 72 ч), или после тотальной панкреатэктомии).
- Критерии исключения: тяжелые заболевания, которые могли ограничить участие в исследовании или препятствовать его завершению; недавно проведенные объемные хирургические вмешательства; кишечная непроходимость или острый живот; злокачественные опухоли органов пищеварения, кроме рака поджелудочной железы, в течение последних 5 лет; любая злокачественная опухоль с явными проявлениями; СПИД; целиакия; болезнь Крона; псевдокиста поджелудочной железы размером 4 см и более; продолжающееся злоупотребление алкоголем или лекарственная зависимость.
- Был разрешен прием в стабильной дозе препаратов, влияющих на дуоденальную pH, скорость эвакуации из желудка и желчеобразование. Препараты, которые могли влиять на эффект изучаемого препарата, например другие ферментные препараты для заместительной терапии или антидиарейные средства, были запрещены.
- Все больные обследовались и лечились под строгим контролем в стационарах. Для подтверждения соответствия критериям включения в периоде прескрининга больные проходили 5-дневный односторонний слепой период приема плацебо (подготовительный период — исходный период исследования).
- Пациенты соответствовали критериям включения при условии, если общее содержание жира в кале за 72 часа составляло 40 г и более, а коэффициент абсорбции жира < 80% в период приема плацебо перед вступлением в двойную слепую фазу.
- Диетологом исследовательского центра заранее с учетом пожеланий больного составлялась индивидуальная диета, содержащая 100 г в день и более жира, чтобы гарантировать прием не менее 80 г жира в день.
- Пациенты были рандомизированы в соотношении 1:1 на две группы: принимающие капсулы панкреатической липазы с медленным высвобождением (72000 USP липазы на основной прием пищи и 36000 USP липазы на промежуточный прием пищи) и принимающие плацебо в течение 7 дней per os во время приема пищи.
- Сбор кала в течение 72 часов проводили в подготовительный период и двойной слепой период для изучения содержания жира и азота в кале. Пациенты принимали одну дозу пищевого красителя синего цвета (500 mg FD&C Blue #2 indigo carmine), чтобы отметить начало и вторую дозу того же красителя через 72 часа, чтобы отметить окончание каждого периода сбора кала.
- Пациенты вели ежедневный дневник симптомов со стороны желудочно-кишечного тракта в подготовительном периоде и в периоде рандомизации, а также пищевой дневник в течение обоих 72-часовых периодов сбора кала.
- Первичным критерием эффективности было изменение коэффициента абсорбции жира в течение от подготовительного периода до конца двойного слепого периода: коэффициент абсорбции жира (%) = 100 [(принятый жир, г — выделившийся с калом жир, г) / принятый жир, г].
- Вторичные критерии включали коэффициент абсорбции азота, который рассчитывали следующим образолл: коэффициент абсорбции азота (%) = 100 [(принятый азот, г — выделившийся с калом азот, г) / принятый азот, г].
- Другие вторичные критерии включали показатели жира и азота в кале, клинические симптомы, которые оценивал исследователь путем расспроса больного о частоте стула (количество дефекаций в день), средней характеристике консистенции стула (0 = плотный, 1 = сформированный/нормальный, 2 = мягкий, 3 = водянистый), средней выраженности флатуленции (0 = отсутствует, 1 = легкая, 2 = умеренная, 3 = выра- женая), средней выраженности абдоминальной боли (0 = отсутствует, 1 = легкая, 2 = умеренная, 3 = выраженная).
Оценка безопасности включала объективные данные, витальные показатели, лабораторные данные и контролирование побочных явлений в соответствии с MedDRA (Medical Dictionary for Regulatory Activities).
- Общее количество рандомизированных пациентов — 54 (25 вошли в группу панкреатической липазы, 29 — в группу плацебо), 52 пациента завершили двойной слепой период.
- Демографическая характеристика была сходной в двух лечебных группах, хотя в группе панкреатической липазы было больше больных, перенесших хирургические вмешательства на поджелудочной железе.
- Динамика коэффициентов абсорбции жира и азота после подготовительного периода была существенно более выраженной в группе панкреатической липазы по сравнению с группой плацебо.
- Большая часть пациентов обеих групп имела отрицательные показатели коэффициента абсорбции азота в подготовительном периоде.
- В группе плацебо показатели коэффициента абсорбции азота оставались отрицательными к концу двойного слепого периода, что давало основание думать об отрицательном белковом балансе у этих больных.
- По данным пищевых дневников больных оказалось, что 72-часовое общее потребление жира и азота было сходным в обеих группах.
- В группе панкреатической липазы было получено значительное улучшение характеристик стула по сравнению с группой плацебо.
- Значительное улучшение клинической симптоматики наблюдалось в группе панкреатической липазы по сравнению с группой плацебо.
- Не было достоверной разницы в частоте побочных явлений, требующих дополнительного лечения, в группе панкреатической липазы по сравнению с группой плацебо; зарегистрированные побочные эффекты были преимущественно со стороны желудочно-кишечного тракта, касались нарушения метаболизма и трофики.
- В каждой группе было по одному пациенту, у которых, по мнению исследователя, побочные эффекты были связаны с лечением.
- Не было серьезных побочных явлений или случаев смерти.
- В группе плацебо был зарегистрирован один случай тяжелого побочного явления (абдоминальной боли).
- В настоящем исследовании не было случаев прекращения приема препарата из-за побочных явлений.
- Капсулы панкреатической липазы 12000 USP с постепенным высвобождением эффективны в лечении мальдигестии, связанной с внешнесекреторной панкреатической недостаточностью вследствие хронического панкреатита и оперативных вмешательств на поджелудочной железе в дозах 72000 USP на основной прием пищи и 36000 USP на промежуточный прием пищи.
- Получено значительно более выраженное улучшение коэффициентов абсорбции жира и азота по сравнению с подготовительным периодом в группе панкреатической липазы по сравнению с группой плацебо.
- Необходимы дальнейшие исследования для лучшей оценки белкового статуса у больных с хроническим панкреатитом и после хирургических вмешательств на поджелудочной железе.
- Длительность улучшения в отношении клинических проявлений мальдигестии по сравнению с подготовительным периодом была большей в группе панкреатической липазы по сравнению с группой плацебо, включая более значительное улучшение в отношении характеристик стула, его консистенции, и флатуленции.
- Панкреатическая липаза хорошо переносилась, а профиль побочных явлений был сходным с группой плацебо. Количество побочных явлений, возникших при приеме препарата, было небольшим; это были побочные явления преимущественно со стороны желудочно-кишечного тракта, касались нарушения метаболизма и трофики, могли быть отнесены к основному заболеванию.
- Обобщенные результаты двойного слепого, рандомизированного, плацебо-контролируемого исследования со всей очевидностью доказали эффективность и безопасность панкреатической липазы в капсулах с медленным высвобождением и содержанием липазы 12000 USP в лечении внешнесекреторной панкреатической недостаточности вследствие хронического панкреатита или хирургических вмешательств на поджелудочной железе.
Режим приема и доза Креона не зависят от того, какое оперативное вмешательство перенес больной, а зависят от степени внешнесекреторной недостаточности поджелудочной железы.
Существуют 3 принципиальные стратегии назначения ферментных препаратов (рис. 3):
- постоянный (пожизненный) прием ферментных препаратов;
- прием ферментных препаратов для создания «функционального покоя» поджелудочной железы, т. е. в период обострения хронического панкреатита и некоторое время после него (10-14 дней);
- прием ферментных препаратов «по требованию» — для купирования диспепсии после переедания.
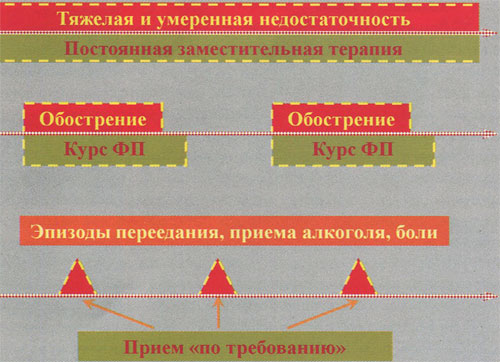
Рис. 3. Стратегия назначения ферментных препаратов (объяснение в тексте)
1-я стратегия должна быть выбрана для больных со сниженными показателями функциональных тестов, прежде всего, фекальной эластазы-1. Т. е., при наличии снижения внешней секреции поджелудочной железы вследствие ее фиброза, атрофии, кистозного перерождения — вследствие органических причин (при хроническом панкреатите, муковисцидозе и др.) вряд ли можно надеяться на спонтанное или даже под влиянием лечения восстановление собственной панкреатической секреции. Напротив, необходимо вовремя назначить адекватные дозы Креона для постоянного приема. Это касается и некоторых больных с легкой, но устойчивой внешнесекреторной недостаточностью поджелудочной железы. Такой подход позволяет не только устранять, но и предотвращать проявления трофологической недостаточности. Безусловно, именно такой режим постоянного приема ферментных препаратов показан больным, перенесшим оперативные вмешательства на поджелудочной железе, т. к. у них уменьшена масса паренхимы железы, и восстановление самостоятельной полноценной панкреатической секреции невозможно.
2-я стратегия — применение ферментных препаратов для купирования боли и диспепсии во время обострения хронического панкреатит и после него.
3-я стратегия применяется у здоровых людей при переедании (рис. 3).
Безусловно, доза Креона должна быть различной в зависимости от степени панкреатической недостаточности (рис. 4). Легче всего оценивать эту степень по результатам фекального эластазного теста. При легкой недостаточности (эластаза-1 150-200 мкг/г) достаточно назначения 30000 ЕД FIP липазы в сутки (Креон 10000 по 1 капсуле 3 раза в день); при умеренной недостаточности (эластаза-1 100-150 мкг/г) — 30000-100000 ЕД FIP липазы в сутки (от Креона 10000 по 1 капсуле 3 раза в день до Креона 25000 по 1 капсуле 4 раза в день): при тяжелой недостаточности (эластаза-1 менее 100 мкг/г) — более 100000 ЕД FIP липазы в сутки (от Креона 25000 по 1 капсуле 4-5 раз в день до Креона 40000 по 1 капсуле 3 и более раз в день).
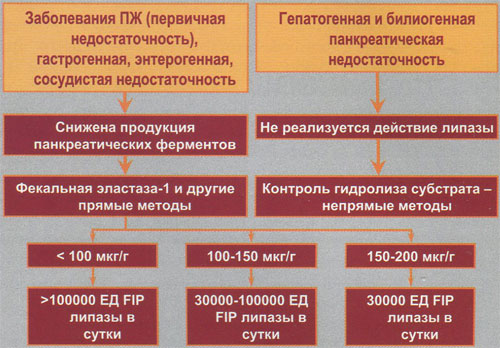
Рис. 4. Алгоритм выбора дозы Креона
При вторичной билиогенной, хологенной недостаточности, внепанкреатической стеаторее следует учитывать выраженность последней, которая не соответствует результатам прямого зондового исследования, показателям эластазы-1 в кале (выраженная стеаторея при сохраненной функции поджелудочной железы). В этих случаях необходимо при выборе дозы Креона ориентироваться на динамику показателей непрямых тестов и добиваться исчезновения стеатореи, нормализации результатов 13С-триглицеридного дыхательного теста и т. д..
При тяжелой панкреатической недостаточности дозы Креона должны быть такими, которые представлены в таблице. Это обосновано следующими фактами. Доказано, что нарушение гидролиза жиров со стеатореей развивается только в тех случаях, когда сохраняется 10% и меньше от исходной нормальной внешней секреции поджелудочной железы. Это означает, что для обеспечения достаточного уровня гидролиза и всасывания жиров необходимо, чтобы в дуоденальном просвете после приема пищи было обеспечено наличие не менее 30000 ЕД FIP активной липазы. Следовательно, заместительная терапия должна назначаться в такой дозе, чтобы именно указанная выше активность липазы достигла двенадцатиперстной кишки вместе с химусом. Только таким образом можно предотвратить стеаторею и прогрессирование мальнутриции. В связи с этим, общепринятая терапия внешнесекреторной недостаточности поджелудочной железы предусматривает назначение 25000-40000 ЕД FIP -липазы с каждым основным приемом пищи (завтрак, обед, ужин). С промежуточными приемами пищи (легкая закуска, полдник и др.) пациент должен принимать 10000-25000 ЕД FIP липазы (таблица). Ферментные препараты с целью заместительной терапии необходимо принимать во время еды или непосредственно до приема.
|
|
Единицы активности липазы (FIP) |
|
Завтрак (основной прием пищи) |
25000-40000 |
|
Промежуточный прием пищи |
10000-20000 |
|
Обед (основной прием пищи) |
25000-40000 |
|
Промежуточный прием пищи / кофе |
10000-25000 |
|
Ужин (основной прием пищи) |
25000-40000 |
|
Прием пищи на ночь |
10000-20000 |
Указанные в таблице дозы Креона при тяжелой панкреатической недостаточности являются начальными, но не всегда достаточно эффективными. В этих случаях необходимо действовать по алгоритму, представленному на рис. 5. Алгоритм назначения ферментных препаратов больным, перенесшим оперативные вмешательства на поджелудочной железе и/или желудке, тонкой кишке, представлен на рис. 6.
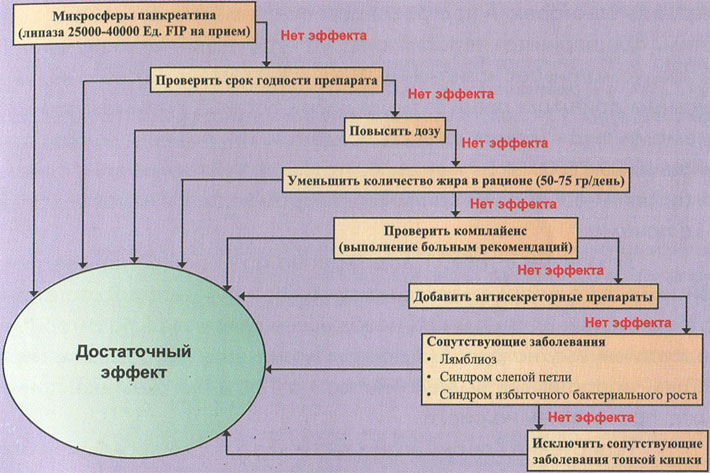
Рис. 5. Алгоритм тактики заместительной терапии при панкреатической недостаточности (по P. Layer et al., 2005; J.-M. Lohr, 2010)
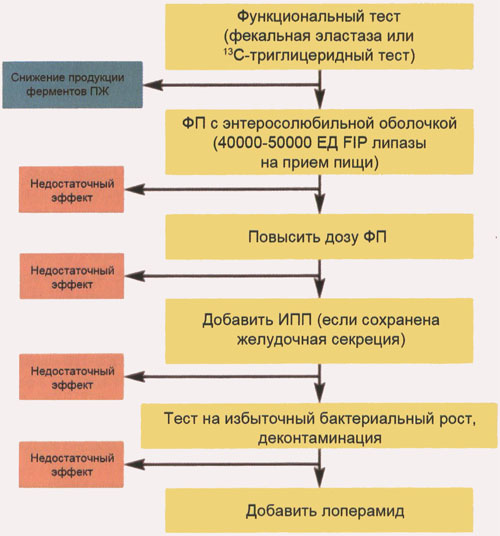
Рис. 6. Терапевтический алгоритм лечения мальдигестии у больных после операции на поджелудочной железе, желудке, тонкой кишке (по J.E. Dominguez-Munoz, 2005)
Назначение Креона возможно вскоре после проведения оперативного вмешательства. Необходимым условием является нормализация активности панкреатических ферментов в крови и моче. Как только такая нормализация произойдет, можно и нужно назначать Креон. У больных, получающих раннее энтеральное питание, Креон должен быть назначен одновременно с этим питанием.
Заместительная терапия должна сопровождаться коррекцией трофологических нарушений и изменений моторики пищеварительного тракта, препаратами, направленными на устранение синдрома избыточного бактериального роста, лечение инкреторной недостаточности поджелудочной железы.
В заключение еще раз важно подчеркнуть, что адекватное ведение больных, перенесших оперативные вмешательства на органах пищеварения, является абсолютно принципиальным. Хирурги вкладывают большие усилия в выполнение сложных хирургических операций. Нередко мы сталкиваемся с больными, которым успешно выполнено оперативное лечение, но качество жизни в отдаленный период очень низкое из-за проявлений трофологической недостаточности поджелудочной железы. Преемственность между хирургом и гастроэнтерологом — необходимое условие получения полноценного и долгосрочного результата лечения больных.
Эффективное пищеварение – основа жизненных процессов. В условиях нарушенного пищеварения...
Согласно статистике, обострение заболеваний желудочно-кишечного тракта становится одним из...
Мало кто задумывается, что на отдыхе человека подстерегают серьезные опасности –...
Все большее количество людей обращается к врачам за специализированной помощью с жалобами на...
Диагностика заболеваний поджелудочной железы одна из наиболее трудных задач в...
анализы, БАД, биологическая медицина, витамины, гастроэнтерология, гигиена, гинекология, гомеопатия, дерматология, диагностика, диетология, заболевания, иммунология, инфекционные заболевания, инфекция, исследования, кардиология, кожа, косметика, красота, лекарственные растения, лечение, лицо, неврология, обследование, оздоровление, онкология, ортопедия, педиатрия, питание, пищеварительная система, поведение, похудение, препараты, продукты, профилактика, процедура, психология, пульмонология, рак, реабилитация, сердечно-сосудистая система, ССС, тело, терапия, травматология, уход, фитотерапия, хирургия, эндокринология
Показать все теги

Комменатрии к новости