Ишемический инсульт и геморрагическая трансформация. Часть 1
Геморрагическая трансформация ишемического инфаркта представляет собой область инфаркта...
Специалистам / Практика / Практика (статья)
 ИнсультГеморрагическая трансформация ишемического инфаркта представляет собой область инфаркта головного мозга, пропитанную компонентами крови, преимущественно эритроцитами. Нарушение проницаемости гематоэнцефалического барьера вследствие ишемии эндотелия капилляров приводит к выходу компонентов крови за пределы сосудов. Геморрагическая трансформация входит в структуру естественного течения некоторых форм ишемического инфаркта, особенно церебральной эмболии, но она может быть ускорена или усилена терапевтическими вмешательствами, которые применяются в острой фазе ишемического инсульта.
ИнсультГеморрагическая трансформация ишемического инфаркта представляет собой область инфаркта головного мозга, пропитанную компонентами крови, преимущественно эритроцитами. Нарушение проницаемости гематоэнцефалического барьера вследствие ишемии эндотелия капилляров приводит к выходу компонентов крови за пределы сосудов. Геморрагическая трансформация входит в структуру естественного течения некоторых форм ишемического инфаркта, особенно церебральной эмболии, но она может быть ускорена или усилена терапевтическими вмешательствами, которые применяются в острой фазе ишемического инсульта.
ПРОДОЛЖЕНИЕ. НАЧАЛО СМОТРЕТЬ ЗДЕСЬ: Ишемический инсульт и геморрагическая трансформация. Часть 1
У пациентов, которым не проводилось лечение альтеплазой, применение ацетилсалициловой кислоты (АСК) в пределах 48 ч после развития инсульта безопасно, эффективно в отношении профилактики развития повторного инсульта на ранних этапах и связано с улучшением функционального исхода. У пациентов, получающих тромболитическую терапию, предшествующий прием АСК был связан с незначительным повышением частоты развития геморрагической трансформации в испытании по изучению интраартериального тромболизиса проурокиназой. У пациентов, которым внутривенно вводили альтеплазу, напротив, предшествующий прием антиагрегантов (главным образом АСК) не был связан с повышением частоты развития кВМК по результатам исследования NINDS rt-PA и серий случаев, представленных Bravo et al.. Однако Uyttenboogaart et al. зарегистрировали статистически значимое повышение частоты развития кВМК, как и по результатам проведенного Whiteley et al. метаанализа, согласно которому предшествующее использование антиагрегантов было связано с удвоением риска развития ВМК. Несмотря на возрастание частоты развития кВМК, у пациентов, получавших предварительно антиагреганты, были более благоприятные исходы после проведения внутривенного тромболизиса альтеплазой, чем у тех, кто не получал антиагреганты; эти результаты стали основой рекомендаций, согласно которым антиагрегантная терапия при исходной оценке не должна рассматриваться как противопоказание к внутривенному введению альтеплазы у пациентов с острым ишемическим инсультом. Предшествующий прием антиагрегантов может способствовать улучшению показателей артериальной реканализации — ключевой фактор, которым обусловлена польза альтеплазы, и который находится в хрупком равновесии с возможной ролью в стимуляции развития ГТ.
Данные указывают на то, что сочетанный прием АСК и клопидогрела до момента появления симптоматики инсульта повышает риск развития кВМК после внутривенного введения альтеплазы. Согласно данным реестра SITS-ISTR (Safe Implementation of Thrombolysis in Stroke-International Stroke Thrombolysis Register — Международный реестр тромболизиса при инсульте, созданный на базе исследования безопасного внедрения тромболизиса при инсульте) повышена частота развития кВМК (13,4%) при сочетанном приеме АСК и клопидогрела по сравнению с приемом любого из этих препаратов в монотерапии, а отношение шансов составляет 3,2 для кВМК при сочетанном приеме АСК и клопидогрела на момент исходной оценки. Cucchiara et al. при изучении когорты пациентов в исследовании SAINT (Stroke-Acute Ischemic NXY Treatment — Испытание по изучению безопасности и эффективности применения NXY-059 для лечения пациентов с острым инсультом) также определили двойную антиагрегантную терапию АСК и клопидогрелом как фактор риска развития кВМК, при этом показатель кВМК составил 20,6%. Хотя наблюдаемое повышение частоты развития кВМК при проведении сочетанной антиагрегантной терапии не приводило к более неблагоприятным исходам, эти результаты призывают к осторожности при внутривенном введении альтеплазы в таких условиях, а также этот фактор следует учитывать при принятии решения в отношении лечения, особенно при наличии других состояний (пожилой возраст, артериальная гипертензия и тяжелый инсульт), которые, как известно, повышают риск развития ВМК после введения альтеплазы.
Полученные данные не изменяют установленное противопоказание к применению антиагрегантов в течение 24 ч после проведения тромболизиса, поскольку использование антитромботиков статистически значимо повышает частоту развития кВМК после введения альтеплазы. Такая точка зрения была подтверждена в рандомизированном исследовании ARTIS (Antiplatelet therapy in combination with Rt-PA Thrombolysis in Ischemic Stroke — Испытание по применению антиагрегантной терапии в сочетании с тромболизисом рекомбинантным тканевым активатором плазминогена при ишемическом инсульте), в котором изучали, может ли внутривенное введение АСК на ранних этапах после применения альтеплазы (300 мг АСК в пределах 90 мин после начала внутривенного введения альтеплазы) улучшить исходы, вероятно, во избежание повторной окклюзии (которая развивается преимущественно вследствие активации тромбоцитов). Испытание было остановлено досрочно из-за большого количества кВМК (4,3%) в группе альтеплаза+АСК по сравнению с таковым в группе альтеплаза+плацебо (1,6%). При этом различий в частоте благоприятных исходов при оценке через 3 мес в обеих группах не отмечено (54 и 57,2% соответственно).
У пациентов с инсультом также оценивали применение других антиагрегантов. В исследовании AbESTT (Abciximab in Emergency Treatment of Stroke Trial — Исследование по применению абциксимаба при неотложном лечении инсульта) изучали сравнительное применение внутривенного ингибитора гликопротеина Ilb/IIIa (GPIIb/IIIa) абциксимаба в течение 5 ч после развития инсульта и плацебо. При оценке через 3 мес пользы от применения абциксимаба не выявлено и его прием ассоциировался со статистически значимым повышением частоты развития кВМК (5,5% в группе абциксимаба по сравнению с 0,5% в группе плацебо) в течение 5 дней после набора в исследование, что привело к досрочному прекращению исследования. В исследовании, проведенном Torgano et al., изучали сравнительное применение другого ингибитора GPIIb/IIIa — тирофибана и АСК в течение 3 дней у небольшой когорты пациентов (n=150) с острым ишемическим инсультом, получивших лечение на протяжении 6 ч после развития симптоматики. Улучшение неврологических функций при оценке через 72 ч и количество баллов 0-1 по модифицированной шкале Рэнкина (мШР) при оценке через 3 мес наблюдались примерно с одинаковой частотой в обеих группах, при этом кВМК развилось у 1% пациентов в группе тирофибана и у 4% пациентов, получавших АСК, что указывает на достаточный профиль безопасности тирофибана. С точки зрения возможного усиления пользы при проведении тромболизиса было изучено сочетанное применение ингибитора GPIIb/IIIa эптифибатида и альтеплазы в исследовании CLEAR (Combined approach to Lysis utilizing Eptifibatide And Rt-PA in acute ischemic stroke — Испытание по изучению комбинированного подхода к лизису с использованием эптифибатида и рекомбинантного тканевого активатора плазминогена при остром ишемическом инсульте) — исследовании по изучению безопасности применения, которое проводилось с повышением дозы. Его результаты показали, что сочетанное применение альтеплазы и эптифибатида было безопасным по сравнению с введением альтеплазы в стандартной дозе, поскольку кВМК развилось только у 1 (1,4%) из 69 пациентов группы сочетанного применения и у 2 (8,0%) из 25 группы альтеплазы (р=0,17). Эти препараты еще находятся на этапе исследования, но не существует данных в пользу применения ингибиторов GPIIb/IIIa в острой фазе ишемического инсульта.
Применение других антиагрегантов, в том числе тиенопиридинов прасугрела и тикагрелора, было исследовано у пациентов с острыми коронарными синдромами, и проведено сравнение с приемом клопидиогрела. Прием прасугрела был связан с повышением частоты развития значительных кровотечений по сравнению с показателем при использовании клопидогрела, но частота кВМК была невысокой (0,3%) в обеих группах лечения. При проведении исследования с таким же дизайном прием тикагрелора был связан с повышением частоты кВМК, в том числе развитием фатальных ВМК, по сравнению с таковым при использовании клопидогрела. Хотя количество случаев внутримозговых кровотечений было незначительным по результатам обоих исследований, эти данные поднимают вопросы о безопасности применения данных препаратов у пациентов с цереброваскулярной болезнью.
По данным метаанализа испытаний по оценке эффективности и безопасности антикоагулянтной терапии при остром кардиоэмболическом инсульте применение пероральных антикоагулянтов статистически значимо повышало риск развития кВМК, тогда как показатели смертности и инвалидизации были сходными с таковыми у лиц, получавших другое антитромботическое лечение. Поскольку применение пероральных антикоагулянтов связано с повышенным риском развития кВМК, особенно при наличии обширных инфарктов, включение пероральных коагулянтов в терапию после выявления инфаркта головного мозга следует на несколько дней отложить в надежде на то, что это будет способствовать стабилизации проницаемости ГЭБ и снижению риска развития геморрагической трансформации в отдаленный период.
Данные в отношении применения гепарина ограничены в силу невысокой частоты его использования при остром ишемическом инсульте в дозах, необходимых для достижения полной антикоагуляции. Однако данные, полученные в ходе проведения Международного исследования инсульта (International Stroke Trial — IST), в котором гепарин вводили подкожно в монотерапии (5000 или 12 500 ME 2 раза в сутки) либо в сочетании с АСК в течение 14 дней (лечение начинали в пределах 48 ч после развития симптоматики), указывают на наличие статистически значимой связи между кВМК и тяжестью инсульта, дозой гепарина, а также коротким промежутком времени между развитием инсульта и началом лечения. Последний пункт может указывать на то, что раннее начало проведения антикоагуляции гепарином после острого ишемического инсульта, возможно, до того, как развивается спонтанная геморрагическая трансформация, может обусловить особо высокий риск клинической выраженности этого процесса, поскольку ГТ может развиться на фоне установленного антико агуляционного эффекта.
Что касается пациентов, которым внутривенно вводили альтеплазу, то Prabhakaran et al. сравнили риск развития кВМК у пациентов, которым проводили и не проводили пероральную антикоагуляционную терапию на момент развития инсульта. Авторы сообщили, что в группе, принимавшей пероральные антикоагулянты, был в 10 раз выше риск развития кВМК на фоне внутривенного или интраартериального введения альтеплазы, а также проведения механической эмболэктомии. У всех пациентов международное нормализованное отношение (МНО) было ниже 1,7 (медиана МНО 1,04, диапазон 0,82-1,61) в соответствии с современными руководствами, что поднимает проблему безопасности внутривенного введения альтеплазы у пациентов, получающих антикоагулянты на момент развития инсульта. Это наблюдение может быть связано с повышенным показателем реканализации после внутривенного введения альтеплазы под влиянием варфарина, что в результате приводит к повышению частоты развития ГТ.
В области исследования применения механической эмболэктомии post hoc анализ исследований MERCI и Multi MERCI (Mechanical Embolus Removal in Cerebral Ischemia trial — Испытание по изучению механического удаления эмболов при церебральной ишемии) показал, что кВМК развилось у 8,5% пациентов с МНО выше 1,7 по сравнению с 8,6% у пациентов, показатель МНО у которых был ниже или равен 1,7, что указывает на то, что интенсивность антикоагуляции не влияет на риск развития кВМК. De Marchis et al. подтвердили наблюдение в отношении того, что предшествующее применение пероральных антикоагулянтов статистически значимо не повышает риск развития кВМК и не ухудшает прогноз по данным ретроспективного исследования серии последовательных случаев инсульта, когда пациентам проводили интраартериальное лечение, в том числе тромболизис и/или механическую тромбэктомию.
Новый ряд антикоагулянтов — прямой ингибитор тромбина дабигатран и ингибиторы фактора Ха ривароксабан и апиксабан — представляют собой эффективную и безопасную альтернативу варфарину при использовании с целью профилактики инсульта у пациентов с неклапанной фибрилляцией предсердий. Обсуждение присущих им рисков развития внутричерепных кровотечений у пациентов с неклапанной фибрилляцией предсердий лежит за рамками этого обзора, и необходимо получить больше данных о безопасности их применения при лечении острого инсульта у людей при помощи тромболитических средств. Данные экспериментальных исследований указывают на то, что предшествующий прием дабигатрана у мышей с острым ишемическим инсультом безопасен даже в случаях последующего внутривенного введения альтеплазы, но необходимо проведение дальнейших исследований с участием людей, прежде чем будут сделаны выводы о безопасности применения этих новых антикоагулянтов в других условиях, помимо профилактики инсульта у пациентов с неклапанной фибрилляцией предсердий.
Хотя данные различных исследований, в которых применялись вариабельные стратегии реканализации, согласуются не полностью, наличие общей связи между показателями реканализации и риском развития геморрагической трансфузии было зарегистрировано в исследованиях по тромболизису при остром ишемическом инсульте, основанных на применении ангиографии. Полученные данные также указывают на то, что множество дополнительных факторов может оказывать влияние на связь между реканализацией и ГТ.
В исследовании по изучению при помощи ангиографии внутривенного тромболизиса препаратом дутеплаза сообщалось о статистически значимо более высокой частоте развития геморрагической трансформации у пациентов, поздно получивших лечение в рамках 8-часового терапевтического окна (6-8 ч после развития симптоматики) по сравнению с более ранним лечением (0-6 ч после развития симптоматики). Это наблюдение коррелирует с результатами, полученными при изучении экспериментальной модели, согласно которой позднее введение альтеплазы (6 ч после экспериментальной окклюзии артерии) было связано с более тяжелым повреждением микроваскулярного барьера, что приводило к развитию более выраженной геморрагической трансформации. Однако в дальнейшем объединение данных, полученных в ходе проведения ряда испытаний по изучению внутривенного тромболизиса при остром ишемическом инсульте, не подтвердило тот факт, что поздний тромболизис связан с повышенным риском развития ГТ, указывая на то, что само по себе время начала лечения не является фактором риска развития геморрагической трансформации, этот процесс может в большей степени зависеть от временного показателя реканализации.
Время до наступления реканализации может быть более информативным предиктором риска развития кВМК и исходов, чем фактическое время начала лечения. Molina et al. сообщили о том, что подтвержденная результатами транскраниальной допплерографии ранняя (<6 ч) реканализация после окклюзии СМА связана с более благоприятным функциональным исходом, несмотря на развитие геморрагического инфаркта, тогда как поздняя реканализация (>6 ч) приводила к повышению частоты развития кВМК. Кроме того, Molina et al. обнаружили, что выявление геморрагического инфаркта после ранней реканализации (<6 ч) было связано с более благоприятными исходами и уменьшением размера инфаркта по сравнению с этими показателями у пациентов без ГТ, что указывает на то, что геморрагический инфаркт является маркером успешной ранней реканализации. Аналогичные данные были получены при изучении экспериментальной модели окклюзии СМА, в которой отсроченная реканализация (>6 ч) была связана с повышенной частотой развития паренхимальных кровоизлияний и более неблагоприятным прогнозом по сравнению с такими же показателями у животных, у которых реканализация была достигнута на ранних этапах (<6 ч). Эти наблюдения свидетельствуют о том, что продолженное состояние артериальной окклюзии и ишемии может приводить к более тяжелому повреждению сосудистого эндотелия и, следовательно, снижению устойчивости к реперфузии, как показано в исследованиях, проведенных нами с применением сонотромболизиса, согласно результатам которых поздняя реканализация (>6 ч) была связана с более высоким риском развития паренхимального кровоизлияния, чем у пациентов с ранее достигнутой реканализацией (<6 ч). Однако результаты наблюдений более высокого риска развития паренхимального кровоизлияния после отсроченной реканализации не являются универсальными. Dorado et al. при отслеживании артериальной реканализации при помощи транскраниальной допплерографии не выявили различий в показателях развития кВМК среди пациентов с ранней или поздней реканализацией (<2 ч, 2-6 ч, 6-24 ч) после внутривенного введения альтеплазы, при этом они подтвердили ранее полученные данные о более благоприятном функциональном исходе при достижении ранней реканализации (<2 ч).
Данные о применении нескольких различных тромболитических средств согласуются в отношении того, что показатели развития геморрагической трансформации коррелируют с дозой препарата. Сравнение различных тромболитических средств, которые вводили внутривенно пациентам с острым инсультом (стрептокиназа, альтеплаза, десмотеплаза и тенектеплаза), показало в целом сходную частоту развития ГТ при их применении. Сообщалось, что частота развития кВМК после лечения составляет около 6% (стрептокиназа), 6,4% (альтеплаза), 2,2% (десмотеплаза в скорректированной по массе тела дозе, после того, как применение первоначального протокола с фиксированной дозой 25, 37,5 и 50 мг привело к тому, что частота развития кВМК составила 26,6%) и 6,5% (тенектеплаза в дозе 0,25 мг/кг в исследовании с повышением дозы, в котором отказались от применения следующей дозы 0,4 мг/кг из-за того, что при ее использовании частота кВМК составила 15,8%). Эти цифры демонстрируют наличие связи между дозой тромболитического средства и риском развития кВМК, указывая на то, что такой риск зависит не от определенного тромболитика, а, скорее, от его дозы. Кроме того, такой эффект дозы может также играть роль в случаях интраартериального введения тромболитических средств, при которых их вводят в высоких концентрациях локально в место расположения тромба. Такой способ введения по сравнению с внутривенным обычно приводит к повышению частоты развития ГТ. Хотя подобные сравнения затруднены из-за различной тяжести инсульта при исходной оценке и типа тромболитического средства, используемого по данным разных сообщений, результаты экспериментальных исследований с применением альтеплазы, указывающие на наличие эффекта дозы, по всей вероятности, демонстрируют более высокую локальную концентрацию лекарственного препарата в области окклюзированных сосудов при интраартери- альном введении по сравнению с внутривенным.
Интраартериальное введение тромболитического средства связано с повышенной частотой развития геморрагической трансформации по сравнению с внутривенным введением, хотя прогностические факторы могут быть сходными. Среди факторов, повышающих риск развития ГТ при интраартериальном тромболизисе, выделяют наличие после процедуры экстравазации контраста по результатам КТ, повышенное количество микрокатетерных инъекций и более высокую дозу гепарина, использованную при проведении процедуры. Эти факторы указывают на наличие фона: выраженного, вероятно, прогрессирующего повреждения функции ГЭБ при интраартериальных процедурах, прямого локального влияния тромболитического средства и, возможно, дальнейшего усиления геморрагической трансформации из-за антикоагулянтного эффекта гепарина.
В ходе проведения исследования IMS I (Interventional Management of Stroke trial — Исследование no изучению интервенционной тактики ведения при инсульте) было зафиксировано, что проксимальная окклюзия (внутренней сонной артерии) представляет собой предиктор развития геморрагической трансформации, тогда как по данным исследования по изучению внутривенного введения альтеплазы в течение 3 ч после развития инсульта обнаружена сходная частота развития ГТ при окклюзии внутренней сонной артерии и окклюзии других артерий по результатам магнитно-резонансной ангиографии (МРА). Эти противоречивые данные свидетельствуют о необходимости проведения крупных проспективных исследований по изучению влияния локализации артериальной окклюзии на риск развития ГТ после тромболизиса с применением последовательных методов диагностики артериальной окклюзии.
Представленные выше наблюдения подчеркивают особую необходимость установления безопасного и эффективного временного окна для проведения в условиях клинической практики лечения, направленного на реканализацию, — процесс, развивающийся как результат клинических обследований пациентов с острым ишемическим инсультом, у которых различные параметры, влияющие на процессы реканализации, изучают в контексте выживаемости и функционального исхода.
С повышенным риском развития геморрагической трансформации после острого инсульта связаны несколько клинических параметров — как в структуре естественного течения ишемического события, так и при его сочетании с лечением, направленным на реваскуляризацию.
Влияние артериальной гипертензии (АГ) на риск развития геморрагической трансформации было зарегистрировано в ходе проведения исследования EPITHET (Echoplanar Imaging Thrombolytic Evaluation Trial — Исследование по выявлению при помощи эхопланарных методов визуализации кандидатов для проведения тромболизиса), в котором внутривенный тромболизис альтеплазой проводили в течение 3-6 ч после развития инсульта. К факторам, статистически значимо связанным с повышенным риском развития ГТ, отнесли обширный инфаркт, выявленный по данным МРТ (ДВ-МРТ) на этапе исходной оценки, и повышенное систолическое АД в течение 24 ч после лечения. Кроме того, по результатам метаанализа, представленного Whiteley, и анализа исследования ECASS II, проведенного Larrue et al., наличие данных об АГ в анамнезе признано статистически значимым фактором риска развития внутричерепного кровоизлияния после введения альтеплазы. Как и возраст, АГ является, по всей вероятности, влиятельным модификатором риска развития геморрагической трансформации, который реализуется посредством взаимодействия с размером инфаркта — наиболее устойчивым из факторов риска в отношении развития внутримозгового кровотечения после введения альтеплазы.
В целом, гипертермия признана неблагоприятным прогностическим признаком при остром инсульте. Установлено, что повышение температуры тела является независимым предиктором развития геморрагической трансформации у пациентов с острым ишемическим инсультом; это влияние не связано с изменениями концентраций сывороточных биомаркеров функционирования ГЭБ.
Гипергликемия у пациентов с острым ишемическим инсультом связана с риском развития геморрагической трансформации после внутривенного введения альтеплазы, а также интраартериального введения проурокиназы. Согласно данным исследования CASES (Canadian Alteplase for Stroke Effectiveness Study — Канадское исследование по изучению эффективности альтеплазы при инсульте), зарегистрированная стойкая гипергликемия при исходной оценке и через 24 ч представляет собой мощнейший предиктор развития кВМК, смертельного или неблагоприятного исхода при оценке через 90 дней у пациентов, которым внутривенно вводили альтеплазу. Предполагают, что негативное влияние гипергликемии при остром ишемическом инсульте реализуется посредством проокислительного, провоспалительного и прокоагулянтного состояния, вызванного повышением уровня глюкозы в крови, наряду с возрастанием концентрации матриксной металлопротеиназы-9 — маркера нарушения функционирования ГЭБ с предрасположенностью к индуцированию развития ГТ после острого ишемического инсульта.
Обнаружено, что низкие концентрации холестерина в сыворотке крови при исходной оценке, особенно холестерина липопротеинов низкой плотности, на фоне предшествующего лечения статинами или без него коррелируют с повышенным риском развития геморрагической трансформации после проведения тромболизиса при остром ишемическом инсульте. Также влияние низких концентраций холестерина липопротеинов низкой плотности и повышенный риск развития ГТ были зафиксированы у пациентов с острым ишемическим инсультом, которым не проводили тромболизис.
Матриксные металлопротеиназы способны разрушать базальную мембрану сосудистого эндотелия, и существует множество данных о связи повышенной экспрессии матриксной металлопротеиназы-9 с развитием геморрагической трансформации после реперфузии. Повышенные концентрации матриксных металлопротеиназ коррелируют с нарушением проницаемости ГЭБ, формированием отека головного мозга и развитием ГТ по данным экспериментальных моделей инсульта, в которых либо использовали альтеплазу, либо не использовали.
Результаты исследования, проведенного нами с участием пациентов с инфарктом в бассейне СМА, которым внутривенно вводили альтеплазу в течение 3 ч после его развития, показали наличие пропорциональной связи между концентрацией матриксной металлопротеиназы-9 в сыворотке крови и развитием геморрагической трансформации (рис. 5). По частоте развития и типу ГТ соответствует в 24,2% геморрагическому инфаркту и в 12,1% паренхимальному кровоизлиянию. Эти данные указывают на то, что концентрацию матриксной металлопротеиназы-9 следует учитывать при оценке безопасности внутривенного введения альтеплазы, а применение ингибиторов матриксной металлопротеиназы-9 может представлять собой будущую стратегию повышения уровня безопасности применения альтеплазы. Результаты экспериментального исследования инсульта показали, что, несмотря на повышение концентрации матриксной металлопротеиназы-9 в ранних стадиях ишемического инсульта, уровень матриксной металлопротеиназы-2 лучше коррелирует с развитием геморрагической трансформации и связан с распадом белков плотного соединения и базальной пластинки, нарушением ГЭБ и нейрональным повреждением.
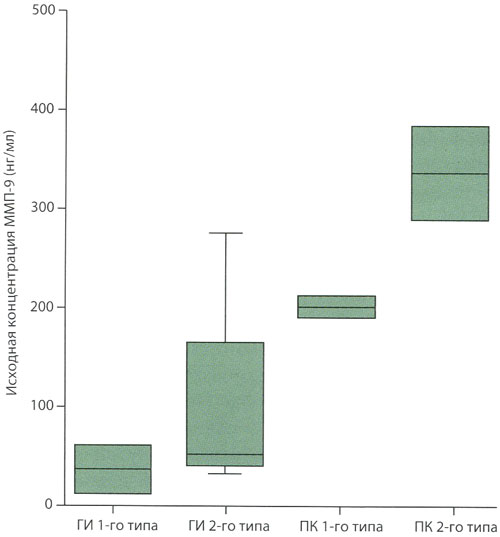
Рисунок 5. Исходные концентрации матриксной металлопротеиназы-9 и риск развития геморрагической трансформации церебрального инфаркта
Пропорциональная связь между концентрациями матриксной металлопротеиназы-9 и частотой развития геморрагической трансформации после внутривенного тромболизиса у пациентов с острым ишемическим инсультом.
ГМ – геморрагическая трансформация
ГИ – геморрагический инфаркт
ПК – паренхимальное кровоизлияние
Фибронектины представляют собой гликопротеины, которые обеспечивают внутриклеточные и клеточно-матриксные взаимодействия. Клеточная форма продуцируется преимущественно эндотелиальными клетками и поэтому повышение концентрации этого биомаркера свидетельствует о сосудистом повреждении. Роль клеточного фибронектина как предиктора развития геморрагической трансформации после тромболизиса у человека была зарегистрирована Castellanos et al., которые отметили, что повышение исходной концентрации клеточного фибронектина пропорционально коррелировало с частотой развития ГТ, при этом низкий уровень был зарегистрирован в группе контроля и у пациентов без геморрагической трансформации, средний уровень — у лиц с геморрагическим инфарктом 1-го и 2-го типов, высокий — у пациентов с паренхимальным кровоизлиянием. Авторы предположили, что показатели клеточного фибронектина в будущем могут обсуждаться при оценке соотношения риск/ польза при проведении внутривенного тромболизиса альтеплазой при инсульте.
Васкулоадгезивный белок 1 (семикарбазид-чувствительная аминооксидаза) представляет собой молекулу клеточной адгезии эндотелия, которая опосредует миграцию лейкоцитов, приводящую к разрушению базальной пластинки и нарушению функции ГЭБ. По результатам клинического исследования исходное повышение концентрации васкулоадгезивного белка 1 в сыворотке крови было пропорционально связано с развитием геморрагической трансформации у пациентов с острым ишемическим инсультом, которым внутривенно вводили альтеплазу.
Foerch et а1. зарегистрировали наличие связи между исходными сывороточными концентрациями белка S100В, астроглиального белка и маркера нарушения функции ГЭБ и развитием геморрагической трансформации у пациентов, получавших внутривенно альтеплазу в течение 6 ч. Этот биомаркер являлся независимым предиктором развития ГТ, хотя его чувствительность была низкой в отношении прогнозирования определенных типов ГТ.
Уровень ферритина как показатель перегрузки железом и усиленного окислительного стресса связан с сочетанным вредоносным воздействием на головной мозг — повреждением ГЭБ и прямым нейротоксическим влиянием. Такое воздействие приводит к стимуляции развития отека головного мозга, геморрагической трансформации, нейрональной гибели и неблагоприятному исходу. При проведении тромболизиса высокие концентрации сывороточного ферритина коррелируют с неблагоприятными исходами, связанными с повышенным риском развития. В некоторых сообщениях установлено наличие связи между концентрацией ферритина в сыворотке крови при исходной оценке и риском развития геморрагической трансформации у пациентов с острым инсультом, которые получали троболитические средства, а также антикоагулянты или антиагреганты. Вероятность того, что сывороточный ферритин играет роль в патогенезе неблагоприятных исходов у пациентов с острым ишемическим инсультом (частично из-за наличия связи с повышенным риском развития ГТ, как спонтанного, так и после проведения тромболизиса), поднимает вопрос: может ли применение хелаторов железа или поглотителей свободных радикалов улучшать исходы у пациентов с ишемическим инсультом?
Обнаружено повышение концентрации циркулирующих белков плотного соединения окклюдина, клаудина 5 и замыкающих контактов у пациентов с острым ишемическим инсультом, у которых развилась ГТ и которым не проводили тромболизис или лечение антикоагулянтами.
Несколько биомаркеров, связанных с функционированием фибринолитической системы, также влияют на риск развития геморрагической трансформации. Ингибитор активатора плазминогена 1 и тромбин-активируемый ингибитор фибринолиза представляют собой эндогенные ингибиторы фибринолиза, которые высвобождаются в кровь после острых ишемических событий. Предполагают, что они вносят вклад в снижение общей фибринолитической активности в этих условиях. По данным клинического исследования было зарегистрировано статистически значимое снижение сывороточной концентрации ингибитора активатора плазминогена 1 при исходной оценке у пациентов, перенесших кВМК после внутривенного тромболизиса альтеплазой. Концентрации тромбин-активируемого ингибитора фибринолиза при исходной оценке были статистически значимо повышены у пациентов с кВМК после тромболизиса. Очевидна парадоксальность такого результата, хотя подобное наблюдение, вероятно, указывает на состояние низкой аффинности тромбин-активируемого ингибитора фибринолиза к тромбину, которая приводила к снижению ингибирования фибринолиза и, следовательно, к усилению растворения тромба. Такое объяснение состояния усиленного фибринолиза подкрепляется нашим наблюдением о наличии связи между повышением концентрации тромбин-активируемого ингибитора фибринолиза и реканализацией на ранних этапах окклюзированной СМА у пациентов, получавших внутривенно альтеплазу.
У пациентов с инсультом сывороточные концентрации продуктов распада фибриногена повышены и могут коррелировать с наступлением неблагоприятных исходов. Обнаружено, что повышение концентрации продуктов распада фибриногена через 2 ч после проведения тромболизиса у пациентов с острым ишемическим инсультом является единственным наиболее значимым предиктором развития ГТ, в том числе паренхимального кровоизлияния или геморрагического инфаркта. Это наблюдение позволило авторам рекомендовать избегать применения антитромботиков в течение не менее 72 ч у пациентов с усиленным распадом фибриногена после тромболизиса.
Эндогенный активированный протеин С представляет собой сериновую протеазу, оказывающую физиологическое антикоагулянтное действие путем инактивации факторов Va и VIIIa, которые необходимы для поддержания образования тромбина. У пациентов с острым инсультом, получивших внутривенно альтеплазу, повышенная концентрация активированного протеина С при оценке через 2 ч после введения альтеплазы была статистически значимо связана с повышенным риском развития паренхимального кровоизлияния и смертности. Такое влияние активированного протеина С может являться отражением инактивации факторов Va и VIIIa помимо повышения сывороточной концентрации тромбин-активируемого ингибитора фибринолиза и инактивации ингибитора активатора плазминогена 1, что приводит к стимуляции фибринолиза.
Фактор свертываемости XIII после его активации тромбином влияет на образование и структуру фибринового сгустка, который становится нерастворимым и защищенным от фибринолиза. Среди вариантов полиморфизма субъединиц фактора XIII форма Val34Leu, как было показано, защищает от развития болезни коронарных артерий, вероятно, из-за усиленного фибринолиза, который наблюдается только в случае, если полиморфизм ассоциируется с высокой концентрацией фибриногена. Эти наблюдения были проанализированы у пациентов с острым ишемическим инсультом, получавших внутривенно альтеплазу. Установлено, что у носителей полиморфизма Val34Leu отмечалась повышенная частота развития кВМК и это влияние было более выражено у лиц с повышенной концентрацией фибриногена.
Прогностическая ценность различных факторов, которые мы обсудили, и потенциал их взаимодействия необходимо рассмотреть в условиях клинического ведения пациентов с острым ишемическим инсультом. Клиницистам, работающим у постели больного и старающимся оценить риск развития геморрагической трансформации, особенно паренхимального кровоизлияния, у пациентов, которым показано выполнение тромболизиса и других реваскуляризационных методик, сочетание клинических и визуализационных данных, полученных в ходе неврологического обследования, и результаты КТ или МРТ, проведенных на ранних этапах, могут помочь выявить пациентов с высоким и низким риском развития ГТ с клиническими проявлениями в первые часы после поступления в стационар с острым ишемическим инсультом (таблица). К признакам, которые наиболее достоверно коррелируют с риском развития геморрагической трансформации, относят тяжесть инсульта на момент поступления согласно оценке по шкале NIHSS, а также данные визуализации, указывающие на обширный инфаркт, который лучше всего подтверждается определением объема дефекта при проведении ДВ-МРТ. Другим фактором, который еще больше увеличивает прогностическую ценность этих сочетанных клинических и визуализационных признаков, является позднее (>3 ч) время реканализации, особенно если ее проводят спустя 6 ч после развития симптоматики.
|
|
Высокий риск |
Низкий риск |
|
КЛИНИЧЕСКИЕ ПРИЗНАКИ |
||
|
Особенности пациента |
Пожилой возраст, артериальная гипертензия, низкий уровень ЛПНП |
Молодой возраст, артериальное давление и показатель ЛПНП в пределах нормы |
|
Клинические проявления при поступлении |
Гипертермия, гипергликемия, высокая балльная оценка по шкале NIHSS (≥ 22 балла) |
Нормотермия, нормогликемия, низкая балльная оценка по шкале NIHSS (от 1 до 5 баллов) |
|
Размер / тип инфаркта |
Обширный / эмболический в пределах бассейна кровоснабжения (СМА, ПМА, ЗМА, мозжечковый) |
Небольшой / лакунарный или вследствие поражения малых сосудов |
|
Получал ли пациент антитромботическую терапию на момент поступления? |
||
|
АСК |
Да |
Нет |
|
Варфарин (МНО ≤ 1,7) |
Да |
Нет |
|
ВИЗУАЛИЗАЦИОННЫЕ ПРИЗНАКИ |
||
|
Компьютерная томография (КТ) |
||
|
Ранние признаки ишемии* |
Да |
Нет |
|
Очаги пониженной интенсивности сигнала, отек, признаки масс-эффекта при поступлении |
Да |
Нет |
|
Лейкоареоз |
Да |
Нет |
|
Зоны с пониженной перфузией по данным ПКТ |
Да |
Нет |
|
Магнитно-резонансная томография (МРТ) |
||
|
Объем инфаркта по данным ДВ-МРТ |
Большой |
Небольшой |
|
Величина ADC |
Низкая |
Высокая |
|
ТРОМБОЛИЗИС |
||
|
Срок достижения реканализации |
Поздний (>6 ч) |
Ранний (<6 ч) |
|
Метод введения тромболитика |
Внутриартериальное введение (с контролем выхода контраста за пределы сосудистого русла при помощи КТ, многократное введение через микрокатетеры, применение в сочетании с гепарином |
Внутривенное введение |
|
СМА – средняя мозговая артерия |
||
Дополнительное соображение относится к использованию антитромботиков, в частности гепарина и гепаринов с низкой молекулярной массой, в острой фазе острого ишемического инсульта и установлению их связи с развитием геморрагической трансформации. Поскольку эти лекарственные средства могут стимулировать развитие ГТ, особенно при обширных инфарктах, и не определена их польза в отношении снижения показателей прогрессирования инсульта на ранних этапах или повторного развития инсульта и наступления смертельных исходов, их применение не рекомендовано в таких случаях. Когда требуется лечение антитромботиками, в частности пероральными антикоагулянтами для вторичной профилактики инсульта у пациентов с фибрилляцией предсердий, рекомендована отсрочка начала лечения на несколько дней от момента развития инсульта в целях снижения риска развития геморрагической трансформации.
Прогностическая ценность биохимических параметров, в частности исходные концентрации биомаркеров, в настоящее время представляют собой многообещающую область будущих исследований, поскольку их диагностическая точность не установлена или недостаточна для их использования при клинической оценке у пациентов, которым показано применение методов реваскуляризации. Однако некоторые из этих биомаркеров являются перспективными в качестве потенциальных методов оценки у таких пациентов в ранний период инсульта (рамка). Попытки будущих исследований в этой области должны быть направлены прежде всего на установление достоверности сывороточных биомаркеров при прогнозировании развития геморрагической трансформации в ходе проспективного изучения когорты пациентов с различными подтипами инсульта и разным уровнем клинической тяжести с включением адекватного количества пациентов с ГТ и, особенно, паренхимальными кровоизлияниями, с целью оценки клинической применимости маркеров. Во II фазе клинические исследования по разработке лекарственных средств, которые могут блокировать воздействие вредоносных циркулирующих биомаркеров, могут помочь в выборе методов профилактики или лечения геморрагической трансформации у пациентов с острым ишемическим инсультом.
|
Изучение ишемического инсульта в экспериментальных и клинических условиях показало, что повышенные концентрации некоторых сывороточных биомаркеров коррелируют с более высокой частотой и большей тяжестью геморрагической трансформации. - Матриксная металлопротеиназа-9 |
Существуют строгие доказательства в пользу того, что матриксные металлопротеиназы, особенно матриксная металлопротеиназа-9, играют центральную роль в патогенезе патологической проницаемости ГЭБ, которая лежит в основе развития геморрагической трансформации. Применение лекарственных средств, которые блокируют высвобождение матриксной металлопротеиназы-9, является многообещающим; превентивное влияние ингибитора фосфодиэстеразы-III цилостазола на развитие ГТ после введения альтеплазы было показано на мышиной модели фокальной ишемии. Цилостазол предотвращает развитие геморрагической трансформации, уменьшает отек головного мозга, предотвращает повреждение эндотелия посредством снижения активности матриксной металлопротеиназы-9, а также препятствует открытию ГЭБ. Другое лекарственное средство, ингибитор широкого спектра матриксных металлопротеиназ ВВ-94, при его сочетании с внутривенным введением альтеплазы, способствовало снижению риска развития ГТ и уменьшению ее тяжести при исследовании крысиной модели окклюзии СМА по сравнению с результатами у крыс, получавших только альтеплазу внутривенно. Ингибитор матриксной металлопротеиназы-9 миноциклин снижает риск развития геморрагической трансформации после внутривенного введения альтеплазы по результатам изучения животных моделей, а по данным испытания MINOS (Minocycline to Improve Neurological Outcome in Stroke human trial — Исследование по изучению влияния миноциклина на улучшение неврологических исходов у людей с инсультом) его применение было связано со снижением плазменной концентрации матриксной металлопротеиназы-9 у лиц, которым внутривенно вводили альтеплазу. Полученные доказательства побуждают к дальнейшему изучению ценности дополнительного применения миноциклина у пациентов, получавших внутривенно альтеплазу, в качестве потенциальной стратегии по снижению частоты кровоизлияний в головной мозг после введения альтеплазы. Эти предварительные наблюдения указывают на то, что лекарственные средства, которые могут угнетать или блокировать активность матриксной металлопротеиназы-9, являются многообещающей целью в качестве дополнительных средств, потенциально снижающих риск развития геморрагической трансформации у пациентов, получавших тромболитики.
Другие подходы, направленные на изучение матриксных металлопротеиназ и их роли в разрушении базальной пластины сосудистого эндотелия, включают в себя применение гипербарической оксигенации и нормобарической гипероксии в качестве методов профилактики ГТ, поскольку снижают активацию матриксных металлопротеиназ. Обе эти процедуры способствовали снижению частоты развития геморрагической трансформации после тромболизиса при изучении крысиной модели ишемического инфаркта на фоне внутривенного введения альтеплазы.
Заслуживает внимания контроль концентрации биомаркеров, повышающих риск развития геморрагической трансформации после проведения тромболизиса, в том числе хелатирование железа, в целях снижения вредоносного влияния ферритина на проницаемость ГЭБ. Другим новейшим методом профилактики развития геморрагической трансформации после тромболизиса является применение иммуносупрессанта такролимуса, которое изучалось на экспериментальной модели инсульта вследствие тромбоза у крыс со спонтанной артериальной гипертензией. По результатам этого эксперимента нейропротекторное действие такролимуса в сочетании с внутривенным введением альтеплазы приводило к снижению частоты и тяжести ГТ по сравнению с показателем у крыс, получавших только альтеплазу, — главным образом за счет снижения частоты развития паренхимального кровоизлияния.
Альтернативный подход к профилактике развития геморрагической трансформации или снижению ее частоты и тяжести после тромболизиса может заключаться в воздействии на фибринолитическую систему. Разработка лекарственных средств, способных модифицировать активность ингибитора активатора плазминогена 1, тромбин-активируемого ингибитора фибринолиза, продуктов распада фибриногена и активированного протеина С, не достигла такого же уровня, как разработка средств, влияющих на проницаемость ГЭБ и матриксные металлопротеиназы. Однако будущие исследования в области разработки лекарственных средств, модифицирующих фибринолитическую систему, в том числе способных контролировать концентрацию фибриногена и тормозить фибринолиз в ранний период после реканализации при остром ишемическом инсульте, вероятно, приведут к созданию стратегий, сочетающих в себе воздействие лекарственных средств, модифицирующих активность матриксных металлопротеиназ и подавляющих фибринолиз, а также способных обусловить повышение безопасности методов реканализации при остром ишемическом инсульте.
Геморрагическая трансформация ишемического инфаркта представляет собой область инфаркта...
В Великобритании было проведено первое в мире клиническое испытание терапии стволовыми...
Интерес к проблеме асимптомного инсульта обусловлен их предполагаемой связью с...
Последние несколько лет были не самыми удачными для бета-адреноблокаторов (БАБ). Дискуссии,...
Ацетилсалициловая кислота (АСК) по своим фармакологическим свойствам и клиническому применению...
анализы, БАД, биологическая медицина, витамины, гастроэнтерология, гигиена, гинекология, гомеопатия, дерматология, диагностика, диетология, заболевания, иммунология, инфекционные заболевания, инфекция, исследования, кардиология, кожа, косметика, красота, лекарственные растения, лечение, лицо, неврология, обследование, оздоровление, онкология, ортопедия, педиатрия, питание, пищеварительная система, поведение, похудение, препараты, продукты, профилактика, процедура, психология, пульмонология, рак, реабилитация, сердечно-сосудистая система, ССС, тело, терапия, травматология, уход, фитотерапия, хирургия, эндокринология
Показать все теги

Комменатрии к новости