Анемия при заболеваниях ЖКТ
В практике гастроэнтеролога анемический синдром встречается достаточно часто. При этом...
Медицина / Патология / Патология (статья)
 AnemiaДефицит витамина В12 (ДВ12) — патологическое состояние, характеризующееся недостаточным содержанием метаболически активных форм витамина В12 (вВ12), которое развивается вследствие его неадекватного поступления с пищей, нарушения всасывания или транспорта в организме.
AnemiaДефицит витамина В12 (ДВ12) — патологическое состояние, характеризующееся недостаточным содержанием метаболически активных форм витамина В12 (вВ12), которое развивается вследствие его неадекватного поступления с пищей, нарушения всасывания или транспорта в организме.
ПРОДОЛЖЕНИЕ. НАЧАЛО ЗДЕСЬ
В диагностике дефицита витамина В12 можно выделить три этапа:
- подтверждение наличия МА и исключение других немегалобластных причин макроцитоза (см. табл. 3; рис. 4);
- дифференциальная диагностика дВ12 и других причин мегалобластного кроветворения: дефицита ФК (табл. 8) и других метаболитов, участвующих в синтезе ДНК (табл. 10);
- установление причины развития дефицита витамина В12 (см. табл. 1).
На рис. 4 и 5 представлены рекомендуемые алгоритмы дифференциальной диагностики макроцитоза и дефицита витамина В12. В настоящее время нет золотого стандарта диагностики дефицит витамина В12, все тесты имеют свои недостатки. Определение уровня сывороточного кобаламина — наиболее часто используемый тест. Несмотря на свои недостатки, он оказался весьма чувствительным у пациентов с клиническими проявлениями дефицита витамина В12, но менее надежным для диагностики субклинического дефицита. Рекомендовано придерживаться некоторых принципов диагностики. Результаты, отличающиеся от нормы, необходимо подтвердить данными дополнительных исследований, особенно если клинические симптомы дефицита витамина В12 сомнительны. Второй тест не должен иметь тех же причин искажения результата, что и первый. Так, уровни гомоцистеина и ММК могут отклоняться от нормы при почечной недостаточности, а концентрации холотранскобаламина и кобаламина связаны с циркулирующим кобаламином. Приемлемым может быть определение уровня сывороточного кобаламина и ММК.
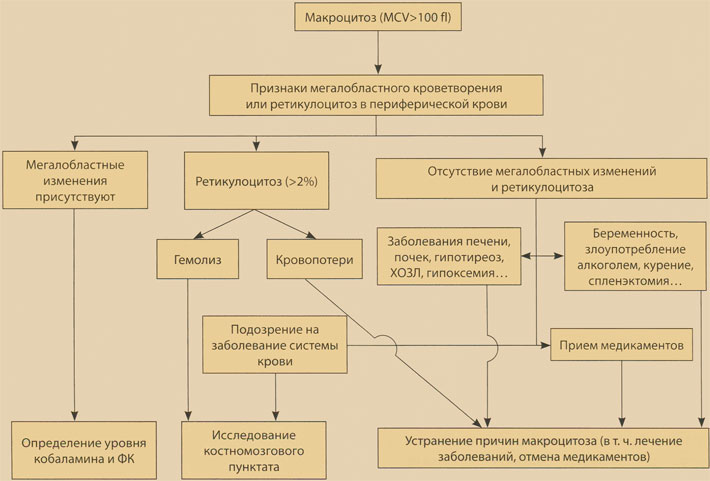
Рис. 4. Алгоритм диагностики макроцитоза
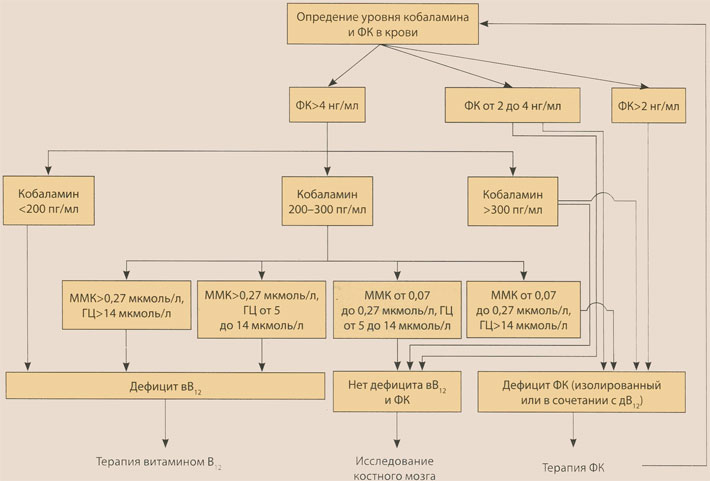
Рис. 5. Алгоритм дифференциальной диагностики дефицита витамина В12 и фолиевой кислоты
Подтверждение наличия МА и исключение других причин макроцитоза. Причины макроцитоза и их распространенность в разных популяциях существенно отличаются. Выделяют мегалобластные и немегалобластные причины макроцитоза (см. табл. 3; рис. 4). Мегалобластные состояния характеризуются наличием в мазке периферической крови макроовалоцитов и гиперсегментированных нейтрофильных гранулоцитов, которые отсутствуют при немегалобластных макроцитарных состояниях. Для мегалобластных состояний характерно наличие лейкопении и тромбоцитопении, а иногда и лейко- и эритробластических изменений. При немегалобластных состояниях в периферической крови, как правило, выявляют макроциты и макроретикулоциты. Поскольку природа возникновения макроцитов при отсутствии дефицита витамина В12 пока не совсем понятна, разграничение мегалобластных и немегалобластных состояний является в некоторой степени условным. Например, при злоупотреблении алкоголем к развитию макроцитоза, как правило, приводят немегалобластные процессы, однако при хроническом алкоголизме часто развивается сопутствующий дефицит фолиевой кислоты и/или витамина В12, обусловливающие возникновение мегалобластного кроветворения.
Дефицит витамина В12 или фолиевой кислоты является причиной макроцитоза лишь у 6-28 % пациентов с высоким MCV.
Гипотиреоз — распространенная (5-12% всех случаев макроцитоза) причина макроцитоза, особенно у лиц пожилого возраста.
По результатам исследования, проведенного в Нью-Йорке, установлено, что прием препаратов для лечения вируса иммунодефицита человека (ВИЧ) является одной из причин макроцитоза (до 13% всех случаев в США). Прием препаратов может обусловить макроцитоз у 2-37% пациентов с высоким MCV (табл. 4).
|
А. Препараты, нарушающие обмен фолиевой кислоты (антифолаты): |
|
- метотрексат, аминоптерин; |
|
Б. Химиотерапевтические препараты (не антифолаты): |
|
- циклофосфамид; |
|
В. Антиретровирусные и другие противовирусные препараты: |
|
- зидовудин; |
|
Г. Противосудорожные препараты: |
|
- фенитоин; |
|
Д. Антибактериальные препараты: |
|
- аминогликозиды (гентамицин, тобрамицин, амикацин); |
|
Е. Пероральные контрацептивы. |
|
Ж. Другие препараты: |
|
- салицилаты; |
Алкоголизм является причиной макроцитоза у 15-36% пациентов с высоким MCV. Умеренный макроцитоз наблюдают у 40-90% лиц, злоупотребляющих алкоголем. Причинами его развития являются дефицит фолиевой кислоты и прямое токсическое действие алкоголя на эритроидный росток кроветворения. При осмотре таких больных обращают на себя внимание гинекомастия, «голова медузы» и желтуха. При алкоголизме MCV, как правило, ниже 110 мкм3 (А). Отказ от приема алкоголя способствует нормализации MCV. Тестом для выявления злоупотребления алкоголем является определение уровня гамма-глютамилтранспептидазы в крови.
Очень часто у пациентов с различными заболеваниями органов кроветворения отмечают повышение MCV. Особенно характерно развитие макроцитоза при таких заболеваниях, как миелодиспластический синдром (МДС), особенно при наличии цитогенетической аномалии «5q-», апластическая анемия, множественная миелома и другие парапротеинемические гемобластозы, острые лейкемии. После начала специфической химиотерапии макроцитоз вследствие нарушения синтеза ДНК на фоне приема цитостатических препаратов развивается у подавляющего числа пациентов.
Причиной макроцитоза при отсутствии макроовалоцитов в периферической крови в редких случаях может быть ложный макроцитоз вследствие:
Холодовые агглютинины приводят к склеиванию эритроцитов в агрегаты, которые автоматический счетчик распознает как макроциты. При гипергликемии кровь является более концентрированной, и когда образец крови автоматически разбавляется для определения MCV, клетки набухают больше, чем обычно, и считываются как макроциты. Повышенная мутность образца крови при выраженном лейкоцитозе также может привести к завышению гемоанализатором размера эритроцитов.
Анемия при дефиците витамина В12 является макроцитарной, но некоторые сопутствующие заболевания могут приводить к снижению MCV и маскировать макроцитоз. Сопутствующий дефицит железа выявляют у половины больных с В12ДА, что существенно затрудняет диагностику этого заболевания. Цветовой показатель и MCV при этих состояниях могут быть нормальными или ниже нормативных значений. Замаскированный макроцитоз встречается при:
Единственным диагностическим тестом, позволяющим однозначно подтвердить или исключить наличие мегалобластного кроветворения, является непосредственное исследование костномозгового кроветворения. Исследование аспирата КМ (пункция) считается в данной ситуации предпочтительным перед исследованием биоптата (трепанобиопсия). Однако проведение пункции или биопсии КМ показано далеко не во всех случаях при подозрении на дефицит витамина В12. Частично показания к проведению исследования костномозгового пунктата представлены в алгоритме диагностики макроцитоза (см. рис. 4).
Биохимические индикаторы дефицита витамина В12. Выраженный внутрикостномозговой гемолиз эритроидных предшественников при дефиците витамина В12 приводит к повышению в крови концентрации билирубина (до 2 мг/дл) за счет непрямой фракции, снижению уровня гаптоглобина и повышению концентрации лактатдегидрогеназы (ЛДГ) (иногда до 1000 МЕ/л). Выраженность отклонения этих показателей от нормы увеличивается по мере прогрессирования заболевания.
Неэффективная утилизация железа и внутрикостномозговой гемолиз при дефиците витамина В12 приводят к повышению уровня сывороточного железа и ферритина, увеличению насыщения трансферрина.
Уровень витамина В12 в сыворотке крови. Доступность и низкая стоимость определения уровня кобаламина в сыворотке крови предопределяют базовую роль этого теста в диагностике дефицита витамина В12, несмотря на его ограниченную специфичность. Уровень сывороточного кобаламина у большинства пациентов с дефицитом В12 обычно низкий, но может быть нормальным при врожденной патологии его метаболизма. Дефицит витамина В12 как причину МА обнаруживают при наличии в сыворотке крови низкой концентрации кобаламина и нормальной — ФК.
В зависимости от используемого метода измерения нижний предел нормального сывороточного кобаламина обычно находится на уровне около 148 пмоль/л (200 пг/мл). Опубликованные оценки чувствительности и специфичности теста для диагностики дефицита витамина В12 отличаются друг от друга. Так, при исследовании чувствительности этого теста в исследовании, проведенном J. Lindenbaum et аl. (1990), было выявлено, что у 90-95% пациентов с дефицитом витамина В12 уровень сывороточного кобаламина был ниже 148 пмоль/л (200 пг/мл), у 5-10% — находился в пределах 148-221 пмоль/л (200-300 пг/мл), менее чем у 1% — превышал 221 пмоль/л (300 пг/мл). Поданным других авторов, только у 86% пациентов с достоверным дефицитом витамина В12 уровень сывороточного кобаламина был ниже 258 пмоль/л (350 пг/мл). При уровне сывороточного кобаламина выше 295 пмоль/л (400 пг/мл) диагноз дефицит витамина В12 исключают.
Дополнительным источником путаницы в литературе является определение уровня кобаламина в пмоль/л, в то время как во многих клинических лабораториях используют нг/л (нг·0,738 = пмоль; пмоль·1,36 = пг. Исходя из этого, 200 нг/л = 148 пмоль/л; пг/мл = нг/л).
При интерпретации результатов определения уровня витамина В12 необходимо учитывать возможные причины ложнонормального (ложноповышенного) и ложноотрицательного результатов (табл. 5).
|
А. Ложнонормальный (ложноповышенный): |
|
1) Миелопролиферативные заболевания: - ХМЛ, 2) Заболевание печени. 3) Наследственный дефицит ТК II. 4) Повышенный бактериальный рост в кишечнике. |
|
Б. Ложнонизкий: |
|
1) Дефицит фолиевой кислоты. |
Причиной ложнонормального уровня сывороточного кобаламина у пациентов с дефицитом витамина В12 и усиленным бактериальным ростом в кишечнике является повышенное производство бактериями биологически неактивных аналогов кобаламина.
Важно отметить, что более чем у 1/3 пациентов с дефицитом фолиевой кислоты уровень сывороточного кобаламина является низким (у некоторых <74 пмоль/л, или 100 пг/мл), который нормализуется после терапии препаратами ФК. Если после приема фолиевой кислоты уровень сывороточного кобаламина не повышается, следует предполагать сочетанный дефицит кобаламина и ФК.
Метилмалоновая кислота. Кобаламин и фолиевая кислота совместно участвуют в ряде важных метаболических путей в клетке. Гидроксильные формы кобаламина играют важную роль в метаболизме гомоцистеина и метилмалонил-КоА. Конверсия гомоцистеина в метионин требует как витамин В12, так и фолиевая кислота (рис. 3). Однако метаболизм метилмалонил-КоА в сукцинил-КоА происходит при участии метилмалонил-КоА мутазы (ММКоАМ), коферментом которой является только витамин В12 (рис. 2 и 3). Индикатором снижения активности этого фермента является повышение уровня ММК в крови.
Результаты исследований, проведенных с участием больших групп пациентов с дефицитом фолиевой кислоты и дефицитом витамина В12, показали возможность дифференциации этих состояний путем определения уровня ММК и гомоцистеина в сыворотке крови. При дефиците витамина В12 отмечают повышение уровня как гомоцистеина, так и ММК. У большинства пациентов с дефицитом ФК концентрация ММК нормальная или незначительно повышена при достоверно повышенном уровне гоцистеина (см. рис. 4). При этом следует иметь в виду, что почти у 50% людей с высокой концентрацией ММК и гомоцистеина уровень сывороточного кобаламина находится в норме. Это свидетельствует о низкой чувствительности использования данного показателя для диагностики дефицита витамина В12, особенно при наличии других признаков или симптомов дефицита витамина В12. Метилмалоновая кислота — более чувствительный маркер выявления дефицита витамина В12 у пациентов без анемии, чем уровень гомоцистеина.
Определять уровень ММК рекомендовано, если при первичном исследовании концентрация сывороточного кобаламина и/или гомоцистеина отличается от нормы. К важным ограничениям, которые необходимо учитывать при оценке уровня ММК, относятся почечная недостаточность (повышение содержания креатинина в сыворотке крови) и гиповолемия, при которых уровень ММК повышается, что снижает чувствительность и специфичность метода в выявлении дефицита витамина В12. При почечной недостаточности повышение уровня ММК и гомоцистеина, как правило, менее значительное, чем при дефиците витамина В12. Измерение концентрации ММК в моче с поправкой на клиренс креатинина может быть полезной альтернативой ее определению в крови, особенно у больных с почечной недостаточностью.
Основные ограничения в определении концентрации ММК: сложность и высокая стоимость проведения анализа, ограниченная доступность и зачастую длительность исследования. В настоящее время большинство лабораторий в Украине не определяют этот метаболит. Нормальная концентрация ММК составляет 0,07-0,28 мкмоль/л. Превышение показателя 0,75 мкмоль/л свидетельствует о наличии дефицита витамина В12, при уровне ниже 0,29 мкмоль/л дефицит витамина В12 исключают, промежуточные значения требуют дополнительных исследований. Дефицит вВ12 может быть диагностирован и при уровне ММК >0,40 мкмоль/л, концентрации сывороточного кобаламина <148 пмоль/л (200 пг/мл) и отсутствии дефицита фолиевой кислоты, витамина В6 и почечной недостаточности.
При интерпретации уровня ММК в крови следует учитывать возможные причины ее повышения или снижения (табл. 6).
|
А. Причины повышения метилмалоновой кислоты: |
|
1) Дефицит витамина В12. |
|
Б. Причины снижения уровня метилмалоновой кислоты: |
|
Угнетение кишечной бактериальной флоры на фоне антибактериальной терапии. |
Антибактериальная терапия, приводящая к сокращению кишечной бактериальной флоры, может обусловливать снижение концентрации сывороточной ММК. Уровень ММК и гомоцистеина повышается с возрастом, хотя это может быть вызвано повышенной распространенностью субклинического дефицита витамина В12 в пожилом возрасте. Диапазон нормальных значений в разных лабораториях отличается.
Определение уровня ММК и гомоцистеина в сыворотке крови — чувствительный метод диагностики дефицита витамина В12. При дефиците витамина В12 повышенный уровень ММК обнаруживают у 86-98% пациентов, гомоцистеина — у 85-96%, обоих метаболитов — у 94%, при дефиците фолиевой кислоты —у 12 и 91 % пациентов соответственно. Оба этих метаболита находятся в пределах нормативных значений лишь у 0,2% пациентов с дефицитом витамина В12 и у 7% — с дефицитом фолиевой кислоты. Повышение концентрации ММК при нормальном уровне гомоцистеина отмечают у 4% пациентов с дефицитом витамина В12 и у 2% — с дефицитом фолиевой кислоты. Повышение уровня гомоцистеина при нормальном уровне ММК выявляют у 80% пациентов с дефицитом фолиевой кислоты и лишь у 1% — с дефицитом витамина В12.
Гомоцистеин. Повышение уровня гомоцистеина является очень чувствительным индикатором дефицита витамина В12. Тем не менее, этот тест имеет существенный недостаток — низкую специфичность. Дефицит витамина В12 составляет лишь малую часть всех случаев повышения уровня гомоцистеина (табл. 7). Он часто повышен при дефиците фолиевой кислоты, злоупотреблении алкоголем и при наличии других причин. Интервал нормативных значений не является универсальным, при незначительном повышении уровня гомоцистеина всегда необходимо учитывать концентрацию креатинина. Неправильное взятие проб и ошибки при проведении исследования являются основными техническими причинами незначительно повышенного уровня гомоцистеина. Для исследования используют плазму с антикоагулянтом, а не сыворотку. Центрифугирование должно быть проведено в течение 1 ч после забора крови. Нормальный уровень гомоцистеина составляет 5,1-13,9 мкмоль/л. Дефицит витамина В12 диагностируют при его значениях >0,13 мкмоль/л и сывороточного кобаламина <148 пмоль/л (200 пг/мл) при отсутствии дефицита фолиевой кислоты, витамина В6 и почечной недостаточности.
|
1. Дефицит витамина В6 вследствие недостаточного поступления с пищей или в результате нарушения всасывания в кишечнике. 2. Наследственные метаболические дефекты обмена гомоцистеина. 3. Прием некоторых препаратов (противосудорожных, сахароснижающих средств, цитостатиков, изониазида и др.) 4. Ассоциация с некоторыми заболеваниями (гипотиреоз, псориаз, трансплантация почек, лейкемия). 5. Почечная недостаточность, повышения уровня креатинина. 6. Гиповолемия. 7. Курение. 8. Алкоголизм. 9. Гиподинамия. |
Холотранскобаламин. Большая часть сывороточного кобаламина связана с ТК I (гаптокоррин), который не может поставлять кобаламин к тканям. Таким образом, измерение фракции кобаламина, связанного с ТК II (холотранскобаламин), теоретически более целесообразно, поскольку этот показатель характеризует концентрацию кобаламина, доступного для клеток. Считается, что низкий уровень холотранскобаламина является самым ранним маркером дефицита витамина В12. Холотранскобаламин является новым маркером, который может оказаться информативным в установлении диагноза раннего дефицита витамина В12 в тех случаях, когда есть расхождения между уровнем витамина В12 и метаболитов (ММК и гомоцистеин). Определение уровня холотранскобаламина может быть использовано при почечной недостаточности или миелопролиферативных заболеваниях, при которых концентрация сывороточного кобаламина может быть ложно повышена. Этот тест обладает большей чувствительностью и специфичностью по сравнению с определением концентрации сывороточного кобаламина. Дефицит витамина В12 диагностируют при уровне холотранскобаламина <35 пмоль/л.
Фолиевая кислота. Нижний предел концентрации ФК в сыворотке крови колеблется в зависимости от технических факторов, но, как правило, он установлен на уровне 6,8 нмоль/л (3 нг/мл). По другим данным, уровень фолиевой кислоты ниже 2 нг/мл считается сниженным, а в пределах 2-4 нг/ мл — пограничным.
При резком ограничении поступления с пищей уровень фолиевой кислоты в сыворотке крови снижается в течение нескольких дней, хотя в тканях может быть нормальным. Возможно, поэтому у 1/3 госпитализированных пациентов выявляют низкий уровень ФК, который при возобновлении адекватного питания быстро нормализуется. Тем не менее, утверждение о том, что кратковременный период адекватного питания нормализует уровень фолиевой кислоты у пациентов с дефицитом, является сомнительным. Концентрация ФК в эритроцитах значительно выше, чем в сыворотке крови, и даже легкая степень гемолиза вызывает ложное повышение фолиевой кислоты в сыворотке крови.
Дефицит фолиевой кислоты в некоторых странах (например, в США) выявляют крайне редко из-за обогащения продуктов питания ФК, применяемой в этих странах. Период беременности, прием противосудорожных препаратов, а также употребление алкоголя могут привести к снижению ее концентрации в сыворотке крови, несмотря на нормальный уровень в тканях. Уровень фолиевой кислоты в сыворотке крови повышается при дефиците витамина В12 (у 20% пациентов), предположительно из-за ухудшения состояния пути метионинсинтетазы и накопления 5-метилТГФК, основной формы ФК в сыворотке крови. Однако у 10% пациентов с дефицитом витамина В12 он парадоксально низкий.
Чувствительность определения фолиевой кислоты в сыворотке крови для диагностики клинически значимого дефицита ФК не установлена. У некоторых пациентов с МА вследствие дефицита ФК ее уровень в сыворотке крови может быть нормальным или слегка сниженным. Этот тест является малоспецифичным. Низкий уровень фолиевой кислоты может быть выявлен при отсутствии дефицита ФК. Потребление алкоголя может привести к кратковременному снижению фолиевой кислоты в сыворотке крови у пациентов с адекватным запасом ФК в тканях.
Фолиевая кислота в эритроцитах. Из-за существующих ограничений в использовании показателя сывороточной фолиевой кислоты иногда целесообразно определять ее содержание в эритроцитах. Эритроциты получают фолиевую кислоты при созревании. В дальнейшем ее уровень в эритроцитах остается постоянным на протяжении всей жизни клетки, поэтому этот показатель менее чувствителен при наличии краткосрочных нарушениях диеты, чем таковой в сыворотке крови. Уровень фолиевой кислоты в эритроцитах сильнее коррелирует с наличием мегалобластных изменений в периферической крови и КМ, чем концентрация в сыворотке крови. Однако и этот метод имеет низкую чувствительность и специфичность, что ограничивает его применение. У 19% беременных и у 31% больных алкоголизмом уровень ФК в эритроцитах снижен (<340 нмоль/л, или <150 нг/мл) при отсутствии признаков мегалобластного эритропоэза. Кроме того, у 60% пациентов с дефицитом витамина В12 низкий уровень фолиевой кислоты в эритроцитах, вероятно, вследствие того, что кобаламин необходим для нормальной передачи 5-метилТГФК от плазмы к клеткам.
Макроцитоз эритроцитов в периферической крови выявляют при других МА, не связанных с дефицитом витамина В12, — дефиците ФК и других метаболитов, участвующих в синтезе ДНК. При проведении дифференциальной диагностики дефицита витамина В12 и дефицита фолиевой кислоты необходимо в первую очередь учитывать данные анамнеза, свидетельствующие о возможном недостаточном потреблении ФК, запасы которой в организме ограничены, поэтому ее дефицит развивается очень быстро. Если полностью ограничить содержание фолатов в пище, то фолиеводефицитная анемия разовьется через 2-4 мес. Неадекватная диета является главной этиологической причиной дефицита фолиевой кислоты. Возможные причины развития дефицита фолиевой кислоты представлены в табл. 8. Дефицит фолатов очень быстро возникает у женщин в период беременности и кормления грудью, детей раннего возраста и быстро растущих подростков.
|
- Пищевые причины - Уменьшение поступления фолиевой кислоты с пищей: (бедняки; голодающие; пациенты психиатрических и лечебных стационаров, особенно при хронической слабости; лица, употребляющие преимущественно козье молоко; культурные и этнические способы приготовления пищи, сопровождающиеся разрушением фолатов; специальные диеты и пищевые поверия с отказом от продуктов, богатых фолатами) - Несоответствие между поступлением и потребностью в фолиевой кислоте |
|
1. Физиологические: период беременности и кормления грудью, ускоренный рост, рвота беременных, грудной возраст. |
|
2. Патологические: гематологические заболевания с гемолизом и компенсаторным усилением эритропоэза, аномальным гемопоэзом; злокачественные заболевания с инфильтрацией костного мозга; псориаз; гемодиализ; воспалительные и метаболичекие заболевания; болезни печени. |
|
I. Нарушение всасывания фолиевой кислоты |
|
- Без патологии слизистой оболочки кишечника: 1) Некоторые препараты (сомнительно). |
|
- С патологией слизистой оболочки кишечника: тропическое спру; целиакия; болезнь Крона; обширная резекция тощей кишки; болезнь Уипла; повышенный бактериальный рост в кишечнике. |
|
II. Нарушение усвоения клетками фолиевой кислоты |
|
Семейная апластическая анемия (редко) |
|
III. Неадекватная утилизация клетками фолиевой кислоты |
|
1) Препараты антагонисты фолатов (метотрексат) 2) Наследственные дефекты ферментов, участвующих в метаболизме фолатов. |
|
IV. препараты, приводящие к множественным нарушениям метаболизма фолатов: |
|
Сульфасалазин, триамтерен, пириметамин, триметоприм, дифенилгидантоин, барбитураты |
|
V. Алкоголь. |
|
VI. Острый дефицит фолиевой кислоты (этиология неизвестна). |
Нарушение всасывания фолиевой кислоты возможно при поносах, энтерите, после резекции тонкого кишечника и при синдроме «слепой кишки». Применение лекарственных препаратов, аналогов или антагонистов ФК, может вызвать развитие фолиеводефицитной анемии. Алкоголь угнетает метаболизм фолатов в организме, поэтому фолиеводефицитную анемию диагностируют у 20-40% лиц, злоупотребляющих алкоголем.
Чаще всего дефицит фолиевой кислоты развивается у лиц молодого возраста, в то время как дефицит витамина В12 возникает преимущественно в старшем возрасте. В клинической картине дефицита фолиевой кислоты преобладают проявления анемического синдрома. Изменения функции пищеварительного тракта выражены меньше, чем при анемии вследствие дефиците витамина В12. Возможны атрофические изменения слизистой оболочки языка и полости рта, но атрофический гастрит и ахилия при сниженной желудочной секреции не развиваются. Неврологическая симптоматика при дефиците фолиевой кислоты отсутствует.
Изменения в крови и костном мозге при дефиците фолиевой кислоты соответствуют морфологической картине В12ДА. Диагностическое значение имеет определение концентрации сывороточного кобаламина и фолиевой кислоты в крови. При наличии типичной клинической картины МА для интерпретации результатов исследований целесообразно использовать пошаговый метод диагностики (табл. 9).
|
I шаг |
|||
|
Уровень сывороточного кобаламина, пг/мл |
Концентрация фолиевой кислоты в сыворотке крови, нг/мл |
Предварительный диагноз |
Необходимость исследования метаболитов |
|
>300 |
>4 |
Дефицит витаимна В12 и фолиевой кислоты маловероятны |
Нет |
|
<200 |
>4 |
Критерий в пользу дефицита витамина В12 |
Нет |
|
200-300 |
>4 |
Необходимо подтвердить наличие дефицита витамина В12 |
Да |
|
>300 |
<2 |
Критерий в пользу дефицита фолиевой кислоты |
Нет |
|
<200 |
<2 |
Возможен: 1) комбинированный дефицит витамина В12 и фолиевой кислоты; 2) изолированный дефицит фолиевой кислоты |
Да |
|
200-300 |
2-4 |
Возможен: 1) дефицит фолиевой кислоты; 2) анемия, не связанная с дефицитом витамина В12 и фолиевой кислоты. |
Да |
|
II шаг |
|||
|
Уровень метилмалоновой кислоты (ММК) (норма 0,07-0,27 мкмоль/л) |
Уровень гомоцистеина (норма 5-14 мкмоль/л) |
Диагноз |
|
|
Повышен |
Повышен |
Подтверждает диагноз дефицита витамина В12, но дефицит фолиевой кислоты все еще возможен |
|
|
В норме |
Повышен |
Вероятен дефицит фолиевой кислоты; у <5% пациентов возможен дефицит витамина В12. |
|
|
В норме |
В норме |
Дефицит витамина В12 исключен |
|
Может быть рекомендован также алгоритм дифференциальной диагностики дефицита витамина В12, дефицита фолиевой кислоты и других состояний, характеризующихся наличием мегалобластных изменений в периферической крови и КМ (рис. 5). В связи с невозможностью широкого использования в клинической практике определения уровня ММК и гомоцистеина в указанном алгоритме рекомендовано исследовать костномозговое кроветворение для подтверждения наличия либо отсутствия дефицита витамина В12 и дефицита фолиевой кислоты при уровне сывороточного кобаламина от 200 до 300 пг/мл.
Кроме приобретенных нарушений, приводящих к развитию дефицита фолиевой кислоты, иногда встречаются заболевания, причиной развития которых являются наследственные нарушения активности ферментов, участвующих в метаболизме фолиевой кислоты. Среди этих нарушений наиболее частым и значимым является наследственный дефект 5,10-метилен-тетрагидрофолат редуктазы (МТНРР). Мутация в гене, кодирующем МТНРК — наиболее распространенная генетическая причина дефицита фолиевой кислоты и повышения уровня гомоцистеина. Клиническая значимость гипергомоцистеинемии описана ниже.
При проведении дифференциальной диагностики дефициа витамина В12 следует учитывать, что МА может развиться не только вследствие дефицита витамина В12 и фолиевой кислоты, но и в результате нарушения функционирования других ферментов, участвующих в синтезе ДНК и РНК (табл. 10).
|
I. Наследственные нарушения синтеза ДНК |
|
- Наследственные нарушения активности ферментов, участвующих в метаболизме оротовой кислоты (оротовая ацидурия). - Наследственная гемолитическая анемия при синдроме Леш-Гайана. - Наследственная МА, поддающаяся лечению тиамином. - Наследственная дисэритропоэтическая анемия. |
|
II. Приобретенные |
|
- Дефицит витамина В6 (тиамина). - Острый эритробластный лейкоз, эритролейкемия. - Рефрактерная сидеробластная анемия. - Препараты, приводящие к ингибированию синтеза ДНК и развитию МА. - Токсические вещества, обуславливающие МА, в т.ч. алкоголь |
Установление причины дефицита витамина В12. После обнаружения дефицита витамина В12 следующим этапом диагностики является установление причины возникновения дефицита для проведения, при возможности, этиологического и патогенетического лечения. Считается, что большинство случаев клинически выраженного дефицита витамина В12 обусловлено наличием ПА, однако это не относится к случаям субклинического дефицита витамина В12 (см. табл. 2). Выявление нарушения всасывания витамина В12 по данным теста Шиллинга является обременительным, дорогостоящим и недоступным.
Дифференциальная диагностика ПА, энтеропатий, повышенного бактериального роста или врожденных нарушений метаболизма кобаламина имеет важное клиническое значение. Так, выявление повышенного бактериального роста предопределяет необходимость этиотропной терапии, а наличие ПА является показанием к выполнению эндоскопического скрининга, направленного на исключение онкопатологии, и проведению пожизненной заместительной терапии вВ12. Критериями диагностики ПА являются:
1. Наличие макроцитарной анемии (Hb <130 г/л для мужчин и <120 г/л для небеременных женщин; MCV >100 А).
2. Наличие хронического (атрофического) гастрита типа А:
А) серологические маркеры (повышение уровня сывороточного гастрина (натощак); снижение уровня пепсиногена I;
Б) гистологические признаки атрофического гастрита.
3. Подтверждение наличия дефицита ВФ:
А) специфические результаты теста Шиллинга; или
Б) серологические маркеры (антитела к ВФ, антитела к париетальным клеткам).
4. Наличие дефицита витамина В12.
ПА характеризуется низким уровнем кобаламина в крови, наличием атрофического гастрита тела желудка и дефицитом ВФ. Диагностическими критериями хронического гастрита типа А являются гистологически подтвержденная атрофия слизистой оболочки тела желудка, гиперплазия энтерохромофиноподобных клеток и гипохлоргидрия на фоне стимуляции пентагастрином. Повышение уровня гастрина и сниженный уровень пепсиногена I являются маркерами, свидетельствующими о повреждении слизистой оболочки тела желудка. Однако диагноз атрофического гастрита должен быть подтвержден результатами гистологического исследования биоптата слизистой оболочки желудка.
Более чем у 90% пациентов, кроме клинически выраженного дефицита витамина В12, имеются различные заболевания пищеварительного тракта, характеризующиеся нарушением всасывания свободного кобаламина. Поскольку ПА является наиболее частым из них, таким пациентам в первую очередь показано определение антител к ВФ (определение антител к париетальным клеткам менее надежно) и уровня гастрина в сыворотке крови. Наличие антител к ВФ свидетельствует о наличии ПА, низкий уровень гастрина в сыворотке крови ставит под сомнение наличие ПА. Определение причин субклинического дефицита витамина В12 вызывает затруднения (см. табл. 2). Несмотря на то, что ПА является редкой причиной субклинического дефицита витамина В12, ее потенциальная опасность требует проведения исследований крови для установления диагноза. У пациентов с субклиническим дефицитом витамина В12 нарушение всасывания свободного кобаламина выявляют в редких случаях. Примерно у 30-40% из них обнаруживают нарушение всасывания кобаламина, связанного с пищей (мальабсорбция пищевого кобаламина). В настоящее время диагностика этого состояния в клинических условиях до конца не разработана. Предлагаемые критерии диагностики мальабсорбции пищевого кобаламина представлены в табл. 11.
|
- Уровень сывороточного кобаламина <150 пмоль/л (200 пг/мл) |
|
- Результаты стандартного теста Шиллинга (с использованием свободного цианокобаламина, меченого 57Co) – в норме |
|
- Результаты модифицированного теста Шиллинга (с использованием радиоактивного кобаламина, входящего в состав пищевого протеина) – аномальны |
|
- Отсутствие дефицита витамина В12 в пище (поступление >2 мкг в день) |
|
- Отсутствие факторов, предрасполагающих к развитию дефицита витамина В12 |
|
1) атрофический гастрит; |
Развитию ПА предшествует субклинический дефицит витамина В12, часто существующий годами, но не во всех случаях ею заканчивается. Строгое вегетарианство обычно вызывает только субклинический дефицит витамина В12, за исключением детей, рожденных и вскармливаемых матерью-вегетарианкой, у которой зачастую выявляют субклиническую недостаточность. Дефицит ТК I может быть причиной необъяснимо низкого уровня кобаламина в 15% случаев, особенно среди пациентов с нормальной концентрацией ММК и гомоцистеина.
Гастрин, пепсиноген. Гастрит типа А, являющийся терминальной стадией ПА, характеризуется наличием аутоантител к париетальным клеткам желудка и/или ВФ, ахлоргидрией, низким уровнем пепсиногена I в сыворотке крови и высокой концентрацией сывороточного гастрина (натощак). Тотальная (пентагастринустойчивая) ахлоргидрия возникает вследствие потери париетальных клеток желудка и выступает диагностическим маркером ПА. ПА является наиболее частой причиной общей ахлоргидрии. Гипергастринемия развивается вследствие ахлоргидрии, приводящей к стимуляции гастринпродуцирующих G-клеток в антральной области желудка. Низкий уровень пепсиногена I в сыворотке крови возникает вследствие утраты главных клеток желез желудка.
Уровень гастрина в сыворотке крови натощак повышен у 80-90% больных с ПА, а также у пациентов с меньшей степенью атрофии желудка, у которых обнаружена мальабсорбция кобаламина, связанного с пищей. Таким образом, повышенный уровень сывороточного гастрина может быть косвенным доказательством мальабсорбции кобаламина, связанного с пищей. Тем не менее тест имеет ограниченную чувствительность и специфичность для выявления субклинической патологии желудка. Чувствительность этой методики для диагностики ПА составляет >80%, а специфичность — <50%. Для ПА характерно повышение уровня гастрина >200 нг/л.
Гистологическое исследование биоптатов слизистой оболочки желудка. Наличие хронического атрофического гастрита типа А может быть подтверждено результатами биопсии желудка. При гистологическом исследовании биоптатов желудка выявляют инфильтрацию мононуклеарными клетками подслизистого слоя с распространением на собственно слизистую пластинку между железами. Клеточный инфильтрат представлен плазмоцитами, Т-клетками и большими В-клетками. Плазматические клетки, входящие в состав инфильтрата, содержат антитела к антигенам париетальных клеток и ВФ. Распространение клеточного инфильтрата на слизистую оболочку сопровождается дегенеративными изменениями в париетальных и зимогенных клетках. В далеко зашедших стадиях поражения слизистой оболочки сокращается число желудочных желез, париетальные и зимогенные клетки исчезают и заменяются слизесодержащими клетками (кишечная метаплазия).
Хронический атрофический гастрит макроскопически характеризуется потерей складок и истончением слизистой оболочки желудка. Прогрессирование хронического атрофического гастрита типа А с развитием атрофии желудка и появлением ПА, скорее всего, происходит в течение 20-30 лет. При ПА у 50% пациентов патологические изменения слизистой оболочки обнаруживают не только в дне и теле желудка, но и в антральном отделе, причем у 27% пациентов диагностируют атрофические изменения. Эти данные убедительно свидетельствуют, что расширение гастрита в антральный отдел необязательно исключает диагноз ПА.
Характерным признаком гистологических изменений при ПА является наличие гиперплазии энтерохромофиноподобных клеток, к развитию которой приводят гипергастринемия и гипацидность. В конечном счете эти патологические изменения являются причиной развития карциноидных опухолей желудка.
Серологические исследования. К сожалению, широкое применение теста Шиллинга ограничено из-за проблем, связанных с необходимостью использования радиоактивных компонентов. Таким образом, в клинической практике наличие собственно дефицита ВФ часто является недоказанным, а ПА диагностируют на основании наличия антител к ВФ. Результаты ранее проведенных исследований свидетельствуют о том, что при ПА антитела к ВФ выявляют в 40-80% случаев в зависимости от возраста и длительности заболевания.
Описано два типа аутоантител к ВФ. Антитела I типа блокируют связывание витамина В12 и ВФ. Их выявляют в сыворотке крови у 70% пациентов с ПА. Антитела II типа связываются с участком ВФ, удаленным от сайта связывания витамина В12 и ответственным за соединение комплекса ВФ — вВ12 с CUBAM-рецепторами кишечника. Их обнаруживают в сыворотке крови у 35-40% пациентов и редко выявляют при отсутствии антител I типа. При использовании высокочувствительного иммуноферментного анализа антитела II типа обнаруживают чаще. Оба типа аутоантител могут быть обнаружены чаще в желудочном соке, чем в сыворотке крови. Выявление циркулирующих антител к ВФ является важным диагностическим маркером хронического гастрита типа А и ПА.
Антитела к париетальным клеткам у 85-90% пациентов с ПА связаны с наличием аутоиммунного гастрита. Однако они являются неспецифическими и часто их обнаруживают у пациентов с аутоиммунными эндокринопатиями, а также у 3-10% здоровых лиц: частота выявления повышается с возрастом от 2,5% в возрасте старше 20 лет до 9,6% — после 70. Отсутствие антител у 10% пациентов с ПА может быть обусловлено неправильно установленным диагнозом, полным связыванием антител с антигеном, исчезновением антител из-за исчезновения антигена или отсутствием образования антител.
У большинства пациентов в плазме крови и желудочном соке выявляют антитела либо к ВФ, либо к париетальным клеткам, либо те и другие. Лишь у некоторых пациентов с ПА эти антитела не обнаруживают (специфичность 98%). Чувствительность и специфичность выявления антител к париетальным клеткам составляют >90 и <50% соответственно.
Антитела к ВФ являются более специфичными, но менее чувствительными, чем антитела к париетальным клеткам. Антитела к ВФ редко выявляют у здоровых лиц и у больных с другими аутоиммунными нарушениями, хотя могут быть обнаружены у некоторых пациентов с болезнью Грейвса.
Использование антител к ВФ в диагностике ПА имеет 37% чувствительность и 100% специфичность, к париетальным клеткам — 81,5 и 90,3% соответственно. Комбинированная оценка этих антител повышает чувствительность методики до 73% при сохранении 100% специфичности.
В лаборатории клиники Мейо показанием к проведению исследования крови на наличие антител к ВФ является уровень кобаламина ниже 150 пг/мл. При выявлении антител к ВФ у таких пациентов диагностируют ПА. Если у пациентов с отсутствием антител к ВФ уровень гастрина в крови превышает 200 нг/л, то диагностируют ПА. При уровне кобаламина от 150 до 300 пг/мл вначале необходимо определить концентрацию ММК. Тестирование на наличие антител к ВФ необходимо выполнять лишь при повышении уровня ММК выше 0,4 мкмоль/л. В случае их выявления диагностируют ПА. У пациентов без антител к ВФ необходимо определить уровень гастрина. В случае его повышения также диагностируют ПА.
В практике гастроэнтеролога анемический синдром встречается достаточно часто. При этом...
Дефицит витамина В12 (ДВ12) — патологическое состояние, характеризующееся недостаточным...
Дефицит витамина В12 (ДВ12) — патологическое состояние, характеризующееся недостаточным...
Дефицит витамина В12 (ДВ12) — патологическое состояние, характеризующееся недостаточным...
Ученые продолжают спорить относительно долгоиграющих эффектов диет со сниженным содержанием...
анализы, БАД, биологическая медицина, витамины, гастроэнтерология, гигиена, гинекология, гомеопатия, дерматология, диагностика, диетология, заболевания, иммунология, инфекционные заболевания, инфекция, исследования, кардиология, кожа, косметика, красота, лекарственные растения, лечение, неврология, неонатология, обследование, оздоровление, онкология, ортопедия, педиатрия, питание, пищеварительная система, поведение, похудение, препараты, продукты, профилактика, процедура, психология, пульмонология, рак, реабилитация, сердечно-сосудистая система, ССС, тело, терапия, травматология, уход, фитотерапия, хирургия, эндокринология
Показать все теги

Комменатрии к новости