Ранняя диагностика колоректального рака
Согласно данным эпидемиологических исследований, в последние десятилетия в мире отмечается...
Медицина / Патология / Патология (статья)
 Вирус папилломы человекаВирусы папилломы человека (ВПЧ) — крупное семейство мелких вирусов, содержащих двухцепочечную дезоксирибонуклеиновую кислоту (ДНК), которые инфицируют плоскоклеточный эпителий. Установлено, что инфицирование определенными типами ВПЧ является фактором, способствующим развитию различных вариантов аногенитального рака, включая злокачественные новообразования наружных женских половых органов, влагалища, ануса, полового члена, а также некоторых форм рака головы и шеи.
Вирус папилломы человекаВирусы папилломы человека (ВПЧ) — крупное семейство мелких вирусов, содержащих двухцепочечную дезоксирибонуклеиновую кислоту (ДНК), которые инфицируют плоскоклеточный эпителий. Установлено, что инфицирование определенными типами ВПЧ является фактором, способствующим развитию различных вариантов аногенитального рака, включая злокачественные новообразования наружных женских половых органов, влагалища, ануса, полового члена, а также некоторых форм рака головы и шеи.
Приблизительно 4% всех случаев рака связаны с вирусом папилломы человека. ВПЧ-инфекция является основной причиной рака шейки матки и остроконечных кондилом. Генитальная ВПЧ-инфекция очень распространена, передается половым путем, и максимум распространенности приходится на возраст 18-30 лет. От большинства этих инфекций организм освобождается спонтанно, однако у 10-20% женщин они остаются персистирующими с риском прогрессирования заболевания до цервикальной интраэпителиальной неоплазии (cenntal intraepithelial neoplasm — CIN) II-III степени и в конечном итоге — до развития инвазивного рака шейки матки (ИРШМ). CIN — генетически лабильные поражения с 30-40% риском прогрессирования до ИРШМ. При отсутствии лечения они образуют спектр нарастающей цитологической атипии начиная с CIN I легкой степени и заканчивая CIN III тяжелой степени; развитие последних вызывается в основном ВПЧ высокого онкогенного риска — 16-го и 18-го типов. Для возникновения инфекции, вызванной ВПЧ, необходимы микроповреждения генитального эпителия. Онкогенные свойства типов ВПЧ высокого онкогенного риска присущи генам Е6 и Е7, которые в случае экспрессии в делящихся клетках приводят к дерегуляции деления и дифференциации клеток. Показано, что анализ на наличие вируса папилломы человека неизменно превосходит цитологическое исследование в отношении чувствительности и прогностической ценности положительного результата и станет важным инструментом скрининга по выявлению рака шейки матки, по меньшей мере, в развитых странах.
Нобелевская премия по медицине в 2008 г. была присуждена трем вирусологам: Франсуазе Барре-Синусси и Люку Монтенье за открытие вируса иммунодефицита человека (ВИЧ) и Харальду цур Хаузену за выявление роли 16-го и 18-го типов ДНК ВПЧ в развитии рака шейки матки. Вклад цур Хаузена и его коллег в выяснение инфекционной причины рака шейки матки был фундаментальным. В середине 1970-х годов патогномоничная гистологическая особенность папилломавирусной инфекции — койлоцитоз — была описана при умеренных дисплазиях шейки матки, то есть в переводе на современную терминологию — при цервикальной интраэпителиальной неоплазии I степени (CIN I), таким образом связав ВПЧ-инфекцию с цервикальной неоплазией. Эти цитологические и гистологические наблюдения были затем подкреплены строго определенными данными молекулярной вирусологии в основополагающей серии исследований, проведенных в лаборатории цур Хаузена. В них было впервые показано, что клетки большинства остроконечных кондилом содержат последовательности ДНК двух новых типов ВПЧ — 6-го и 11-го, а родственные им, но не идентичные последовательности ДНК, по-видимому, присутствуют при цервикальной карциноме. Затем в новаторской работе исследователи клонировали и описали новые и отличные от ранее выявленных типы ВПЧ — 16-й и 18-й в материале биопсии рака шейки матки и продемонстрировали, что эти ДНК были транскрибированы в линиях клеток рака шейки матки и карцином. Этот фундаментальный труд сформировал молекулярную платформу, которая дала возможность убедительным эпидемиологическим исследованиям Нубии Муньос и ее коллег из Международного агентства по изучению рака в сопоставлении с основами молекулярных экспериментальных и биологических данных показать, что инфицирование специфическими генитальными типами ВПЧ является причиной ИРШМ.
Папилломавирусы — мелкие двухцепочечные ДНК-содержащие вирусы, которые инфицируют плоский эпителий (или клетки с потенциалом превращения в плоский эпителий), вызывая пролиферативные повреждения, типичным примером которых являются неприметные бородавки на коже. Вирусы абсолютно видоспецифичны, поэтому вирус папилломы человека инфицирует только человека, папилломавирус кроликов — только кроликов и так далее. Кроме того, они крайне тропны по отношению к тканям, проходя полный цикл инфицирования только в полностью дифференцированном плоском эпителии.
Папилломавирусы классифицируют не по серотипам, а по генотипам, и в настоящее время около 130 типов ВПЧ, идентифицированных по последовательности генов, кодирующих основной капсидный белок L1, клонированы из материала клинических биопсий. В пределах видов отдельные вирусы показывают предрасположенность к поражению либо кожи, либо слизистых оболочек, а в пределах групп, поражающих кожу или слизистые оболочки, они могут быть разделены на типы высокого или низкого риска в зависимости от онкогенного потенциала. Наиболее четко прослеживается это в клетках половых путей, в которых регулярно или спорадически присутствуют инфекции около 30-40 типов. Их можно разделить на преимущественно ассоциированные с аногенитальными бородавками или кондиломами — 6-й, 11-й и родственные им типы ВПЧ низкого онкогенного риска и те, что ассоциированы с аногенитальным раком и предшествующими поражениями (интраэпителиальной неоплазией), в частности шейки матки,— 16,18,31,33,35,45-й и менее значимые типы ВПЧ. Практически в 100% случаев рака шейки матки — второго по распространенности варианта рака у женщин во всем мире — содержатся ДНК-последовательности генитальных типов ВПЧ высокого онкогенного риска. Наиболее важным является 16-й тип вируса папилломы человека, обнаруживаемый в 50-70% случаев, а также 18-й тип ВПЧ, обнаруживаемый в 7-20% случаев. ВПЧ является канцерогеном не только для шейки матки, но и, в определенной степени, онкопатологии наружных женских половых органов, влагалища, полового члена, ануса, а также головы и шеи, обусловленных ВПЧ-инфекцией высокого онкогенного риска (табл. 1), с преобладающей ролью ВПЧ 16-го типа. Согласно оценкам, около 4% всех злокачественных новообразований связано с ВПЧ, но когда доля злокачественных новообразований головы и шеи, приписываемых ВПЧ, будет более точно установлена, эти данные, вероятно, окажутся заниженными.
|
Локализация в организме |
Развитые страны |
Развивающиеся страны |
|||||
|
Случаев, связанных с ВПЧ (%) |
Случаев рака всего |
Случаев, связанных с ВПЧ |
Все случаи рака (%) |
Случаев рака всего |
Случаев, связанных с ВПЧ |
Все случаи рака (%) |
|
|
Шейка матки |
100 |
83400 |
83400 |
1,7 |
409400 |
409400 |
7 |
|
Половой член |
40 |
5200 |
2100 |
0,0 |
21100 |
8400 |
0,1 |
|
Вульва / влагалище |
40 |
18300 |
7300 |
0,1 |
21700 |
8700 |
0,1 |
|
Анус |
90 |
14500 |
13100 |
0,3 |
15900 |
14300 |
0,2 |
|
Полость рта |
3 |
91200 |
2700 |
0,1 |
183100 |
5500 |
0,1 |
|
Ротоглотка |
12 |
24400 |
2900 |
0,1 |
27700 |
3300 |
0,1 |
|
Всего |
|
5016100 |
111500 |
2,2 |
5827500 |
449600 |
7,7 |
|
Количество случаев рака, связанных с ВПЧ, в 2002 году в развитых и развивающихся странах. Общее количество случаев в мире: 3,7% всех случаев заболевания раком. |
|||||||
Во всех методологически обоснованных исследованиях типа «случай-контроль», использовавших надежные методы определения ДНК ВПЧ, связь между типами ВПЧ высокого риска и ИРШМ является очень сильной с отношениями шансов (ОШ) для ВПЧ 16-го и 18-го типов, равными 280, и жесткими границами доверительного интервала. Степень данной связи исключает возможности случайности, систематической ошибки или конфаундинга (Конфаундинг – феномен исследования, при котором вмешивающийся неучтенный фактор (или конфаундер, конфаундинг-фактор) связан с известным исследуемым фактором и оказывает влияние на результат). Кроме того, такая связь согласуется со столь же сильной связью, обнаруженной в странах с высокой или низкой частотой возникновения рака шейки матки. Имеются надежные обширные проспективные данные, которые четко свидетельствуют, что инфекции с типами вируса папилломы человека высокого онкогенного риска предшествуют развитию CIN II/III степени и, что немаловажно, обнаружение ДНК ВПЧ предшествует первичной цитологической идентификации CIN любой степени с типами ВПЧ высокого риска, особенно ВПЧ 16, предикативного в отношении CIN высокой степени.
Вирус папилломы человека 16 является наиболее распространенным типом, обнаруживаемым при ИРШМ (55%), за ним следует ВПЧ 18 (12,8%), а вместе эти типы приводят к развитию 70% и более ИРШМ, независимо от географической локализации. ВПЧ 33, 45-го и 31-го типов — следующие наиболее часто обнаруживаемые ВПЧ в мире, за исключением Азии, где наиболее распространенными типами ВПЧ являются 58, 33-й и 52-й типы (рис. 1). Тем не менее, вклад этих типов в развитие рака ВПЧ не превышает 4%, и их роль эпизодична по сравнению с ВПЧ 16-го и 18-го типов. Несмотря на то, что аденокарцинома шейки матки, вызываемая ВПЧ 16-го типа, имеет первостепенное значение (48%), также существенный вклад вносят ВПЧ 18-го типа (36%) и ВПЧ 45-го типа (6%).
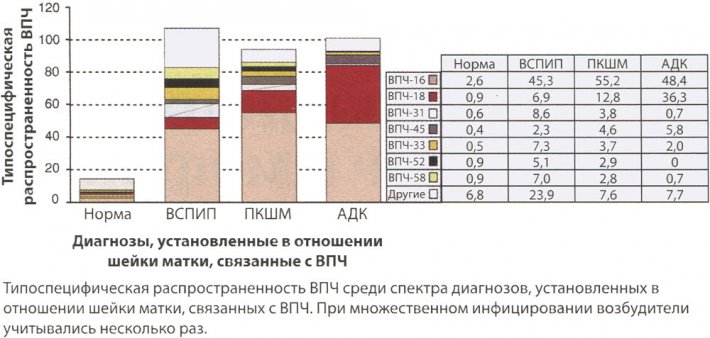 Типоспецифическая распространенность ВПЧ в норме при CIN тяжелой степени и инвазивной карциноме шейки матки
Типоспецифическая распространенность ВПЧ в норме при CIN тяжелой степени и инвазивной карциноме шейки матки
Рис. 1. Типоспецифическая распространенность ВПЧ в норме при CIN тяжелой степени и инвазивной карциноме шейки матки. При множественном инфицировании возбудители учитывались несколько раз. АДК — аденокарцинома, ВСПИП — высокая степень плоскоклеточного интраэпителиального поражения; ПКШМ — плоскоклеточная карцинома шейки матки.
ВПЧ-инфекция очень распространена; большинство женщин в мире в течение жизни оказываются инфицированы генитальными типами ВПЧ с 50-80% риском инициирования за время жизни. В настоящее время, несмотря на географические различия в распространенности, 10,2% женщин с нормальными результатами цервикального цитологического исследования являются ДНК-положительными в отношении ВПЧ при взятии проб из шейки матки. При этом структура инфицирования, зачастую включающая несколько типов вирусов, — это устойчивый максимум частоты у молодых (<25 лет) женщин, быстрое снижение в возрасте 30-40 лет и небольшое повышение в постменопаузальных возрастных группах (рис. 2). Причины подобного повышения у женщин старшего возраста активно обсуждаются; это может быть связано с изменениями в сексуальном поведении, таком как наличие новых партнеров у женщин старшего возраста, приводя к новой или повторной инфекции, или реактивация латентной ВПЧ-инфекции в связи с возрастными изменениями иммунной системы, либо это может быть эффект когорты (Эффект когорты – воздействие определенных событий на поведение индивидов в группе (когорте) в течение какого-либо периода, причем под когортой обычно подразумеваются люди, рожденные примерно в одно время. Люди, родившиеся в одинаковых культурных или исторических условиях, демонстрируют черты сходства в мышлении и поведении, которое можно прямо сопоставить с общим культурно-историческим воздействием).
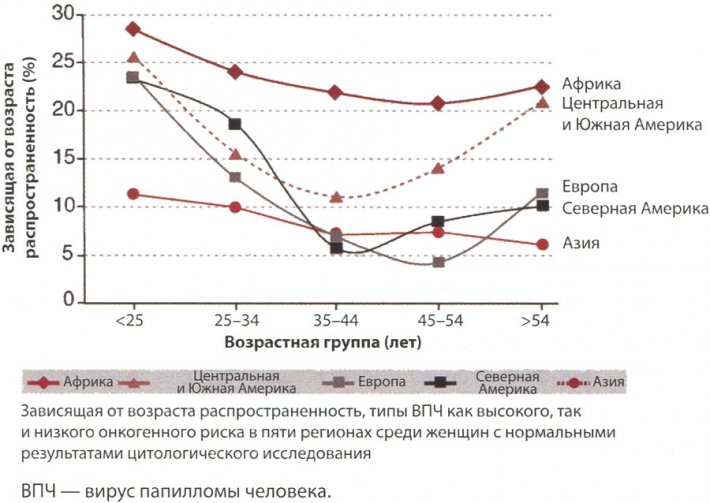 Зависящая от возраста распространенность генитальной ВПЧ-инфекции в мире среди женщин с нормальными результатами цитологического исследования
Зависящая от возраста распространенность генитальной ВПЧ-инфекции в мире среди женщин с нормальными результатами цитологического исследования
Рис. 2. Зависящая от возраста распространенность генитальной ВПЧ-инфекции в мире среди женщин с нормальными результатами цитологического исследования. Генитальная ВПЧ-инфекция максимально распространена в возрасте с 18 до 30 лет, снижения наблюдают в середине жизни с незначительным повышением у женщин в период после менопаузы.
Основные пути передачи генитальной ВПЧ-инфекции — половой акт, как вагинальный, так и анальный; передача требует соприкосновения кожных покровов, а проникновение во влагалище или анус не является обязательным условием. Презервативы обеспечивают некоторую защиту в отношении развития CIN I/III степеней и ИРШМ, а также способствуют регрессии CIN и интраэпителиальных поражений полового члена в конкондартных парах. Систематическое и постоянное использование презервативов необходимо для достижения приблизительно 60% защиты в отношении инфекции; тем не менее ВПЧ может передаваться при контакте с областями незащищенной кожи гениталий, такими как вульва или мошонка. В целом, данные указывают на то, что обрезание у мужчин оказывается защитным средством. Факторы, способствующие передаче, связаны преимущественно с сексуальным поведением, таким как раннее начало половой жизни, количество сексуальных партнеров, появление новых партнеров и длительность половой жизни с каждым из них. Распределение сексуальных взаимоотношений во времени также имеет значение, а именно является ли партнерство по своей структуре периодической моногамией (Периодическая моногамия – форма моногамии, в которой участники имеют только одного сексуального партнера в каждый момент времени, но более одного сексуального партнера в течение жизни) или параллельно существует несколько сексуальных партнеров.
Вирус папилломы человека — мелкие ДНК-вирусы с простым двухцепочечным геномом, который может быть разделен на три домена: некодирующий восходящий регуляторный участок (ВРУ) размером приблизительно в 1 тыс. пар нуклеотидов; ранний (Геном папилломавируса содержит 8-10 генов (в зависимости от типа вируса), которые подразделяются на группы ранних и поздних генов, кодирующих соответствующие белки в соответствии с их функциями. Проникая в клетку, вирус использует клеточные системы для получения собственных белков. В первую очередь синтезируются белки, необходимые для поддержания и репликации вирусной ДНК. Кодирующие их гены обозначаются буквой E(от англ. – early– ранний). К ранним генам относят гены E1-E8. В процессе озлокачествления наиболее важную роль играют гены E6 и E7, которые интегрируются в геном клетки-хозяина и вызывают пролиферацию. После наработки ДНК активируются поздние (late) гены L1 и L2, которые запускают синтез белков вироусного капсида.) участок, содержащий 6 генов — Е6, Е7, Е1, Е2, Е4 и Е5; и поздний участок, кодирующий два гена — L1 (кодирует основной капсидный белок) и L2 (кодирует второстепенный капсидный белок) (рис. 3).
Рис. 3. Геном ВПЧ. НР - начало репликации, бРБ - белок ретинобластомы, ВРУ - восходящий регуляторный участок.
Несмотря на то, что геном небольшой, временная и пространственная структуры его экспрессии сложны и зависят от полностью дифференцированного эпителия (рис. 4). Вирус инфицирует группу недифференцированных базальных клеток при низком количестве копий; через некоторое время после заражения наступает цикл репликации вирусной ДНК, который, по-видимому, зависит от клеточного цикла и увеличивает число копий вируса до приблизительно 50-100 в клетке. Считается, что инфицированная клетка покидает зону недифференцированных клеток-предшественников и входит в пролиферирующую зону эпителия. Затем наступает фаза плазмиды или поддержки эписомального состояния, экспрессия вирусных генов минимальна и, в частности, экспрессия онкогенов Е6 и Е7 находится под очень жестким контролем с едва обнаруживаемой транскрипцией генов Е6/Е7 на мРНК (мРНК – матричная (информационная) рибонуклеиновая кислота; содержит информацию о первичной структуре белков. мРНК синтезируются на основе ДНК в процессе транскрипции, после чего, в свою очередь, используется в ходе трансляции как матрица для синтеза белков). Когда инфицированные кератоциты входят в зону дифференциации, после окончания клеточного цикла происходит массивная активация экспрессии всех вирусных генов с распространенной экспрессией ранних генов Е6 и Е7. Далее происходит репликация вирусной ДНК, количество копий вируса увеличивается до 1000 в одной клетке и, наконец, экспрессия генов белков капсида L1 и L2 и сборка контагиозного вируса. Этот инфекционный цикл занимает около 2-3 нед в условиях in vivo — время, необходимое для перемещения базальных кератоцитов в верхние слои эпителия и дифференциации.
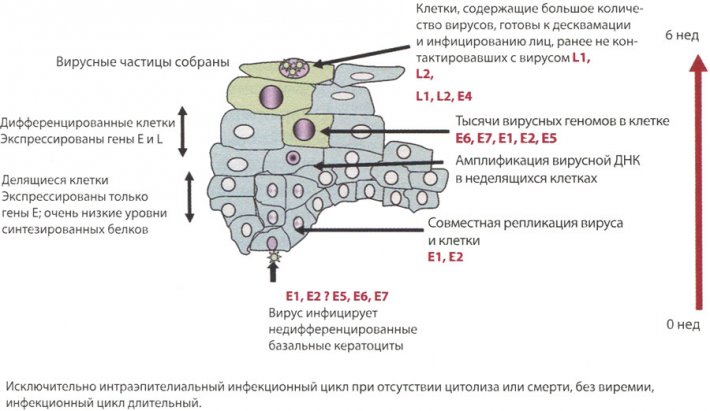 Инфекционный цикл типов ВПЧ высокого онкогенного риска
Инфекционный цикл типов ВПЧ высокого онкогенного риска
Рис. 4. Инфекционный цикл типов ВПЧ высокого онкогенного риска. ВПЧ инфицирует и размножается только в клетках полностью дифференцированного плоского эпителия. Вначале вирус инфицирует относительно небольшое количество кератоцитов базального слоя эпителия шейки матки вследствие микротравм, то есть при ссадинах эпителия, при которых обнажаются базальная мембрана и базально расположенные клетки. После этапа репликации вирусной ДНК число копий вирусного генома увеличивается до 50-100 в клетке, и это количество сохраняется в делящихся клетках. Пока происходит деление клеток, контроль экспрессии вирусных белков ВПЧ высокого онкогенного риска остается очень жестким и уровни экспрессии белков Е6 и Е7 очень низкие. Прекращение деления клетки-хозяина и начало дифференциации в зрелые кератоциты — сигнал к активации всех генов вируса по увеличению вирусных геномов до нескольких тысяч. В поверхностных слоях эпителия происходит экспрессия белков L1 и L2 — многие тысячи вирусных геномов заключаются в капсидную оболочку и происходит распространение контагиозных вирусных частиц.
Важно отметить, что эти события происходят в клетках, которые дифференцируются и вышли из клеточного цикла. Папилломавирус кодирует только одну ДНК-репликацию фермента E1, а репликация вирусного белка E2 полностью зависит от синтетического механизма клеточной ДНК. Проблемой для вируса является то, что необходимые клеточные ДНК-полимеразы и факторы репликации имеются только в делящихся клетках, однако вирус способен размножаться в неделящихся клетках. Для решения этой проблемы вирус папилломы человека кодирует белки, которые на фоне жизненного цикла вируса реактивируют клеточный синтез ДНК в покоящихся клетках, подавляют апоптоз и приостанавливают программы дифференциации инфицированных кератоцитов, создавая условия, способствующие репликации вирусной ДНК. Точные детали того, как это достигается, до конца неизвестны, но вирусные гены, занимающие центральное место в реализации указанных функций, — это Е6 и Е7, и, к несчастью, хотя и редко, побочным результатом этой роли в репликации ВПЧ высокого онкогенного риска являются дерегуляция контроля клеточного роста в инфицированной клетке и развитие злокачественного новообразования.
Краткое изложение течения генитальной инфекции ВПЧ представлено на рис. 5. ВПЧ-инфекция очень распространена среди молодых женщин (и мужчин), ведущих половую жизнь. У большинства — инфекция субклиническая транзиторная, а если при кольпоскопии обнаруживают развившееся поражение, то это — CIN I легкой степени. Большинство ВПЧ-инфекций (наличие ДНК, но без выявления поражения), а также CIN легкой степени разрешаются самостоятельно вследствие развития клеточного иммунитета (КИ), сопровождающегося обычно, но необязательно, сероконверсией и появлением антител к основному капсидному белку L1. У меньшинства женщин (вероятно, 10-15%) не вырабатывается успешного ответа КИ: они остаются ВПЧ ДНК-положительными с персистирующей вирусной инфекцией, то есть с непрерывным образованием контагиозных вирусов. Эта группа женщин, устойчиво инфицированных ВПЧ высокого онкогенного риска, является группой риска развития интраэпителиального поражения тяжелой степени и ИРШМ.
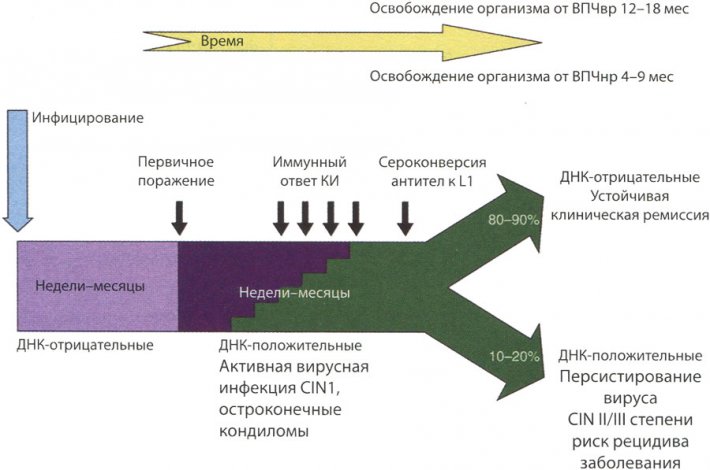 Течение генитальной ВПЧ-инфекции
Течение генитальной ВПЧ-инфекции
Рис. 5.Течение генитальной ВПЧ-инфекции. ВПЧ высококонтагиозен с инкубационным периодом от 3 недель до 8 месяцев и более. У большинства лиц, у которых развились остроконечные кондиломы, это произошло в течение около 2-3 месяцев после инфицирования. Спонтанная регрессия встречается у 10-30% в течение 3 мес. Это связано с развитием соответствующего клеточного иммунного ответа. После регрессии субклиническая инфекция может персистировать в течение всей жизни. Для инфекций, вызванных типами ВПЧ высокого онкогенного риска (ВПЧвр), такими как 16 и 18, характерна такая же структура течения, как и для типов ВПЧ низкого риска (ВПЧнр), но со спонтанной регрессией в течение 12-18 мес.
К сожалению, персистирующие поражения связаны с прогрессированием до CIN II/III степеней и развитием инвазивного рака. КИ — клеточный иммунитет, CIN— цервикальная интраэпителиальная неоплазия.
Эпидемиологические данные показывают, что ВПЧ-инфекция является причиной CIN (всех степеней тяжести) и аденокарциномы in situ (AIS), а инфекция ВПЧ высокого онкогенного риска — основной фактор риска последующего развития аденокарциномы как клеток плоского эпителия, так и шейки матки. Однако показано, что наличия одной только инфекции ВПЧ высокого онкогенного риска недостаточно. Прекурсоры CIN поражений классифицируют гистологически, а каждую из форм спектра гистологической атипии ранжируют по степени потери цитоплазматической зрелости и проявления цитологической атипии. В Европе определяют CIN трех степеней: CIN I — легкая, CIN II — умеренная и CIN III — тяжелая. CIN I может быть связана с типами ВПЧ как высокого, так и низкого онкогенного риска, хотя преобладают типы высокого риска. В большинстве поражений CIN I степени вирус сохраняется как эписома, поддерживая полный цикл репликации вируса, а экспрессия вирусных генов, в частности Е6 и Е7, жестко регулируется. Затем поздние гены экспрессируются, происходит сборка и рассеивание вирусных частиц.
CIN II/III степеней связаны в основном с типами ВПЧ высокого онкогенного риска. В целом, из-за нарушений клеточной дифференциации, что характерно для этих повреждений, CIN высоких степеней не поддерживают полный вирусный инфекционный цикл. Экспрессия поздних генов либо исчезает, либо значительно сокращается; последовательность вирусной ДНК может быть интегрирована в геном клетки-хозяина, и экспрессия онкогенов Е6 и Е7 оказывается дерегулированной с выделением этих онкобелков через эпителий. При CIN III степени всю толщу эпителия занимают пролиферирующие клетки, процессы цитоплазматического созревания минимальны. Характерны аномалии ядер, такие как плеоморфизм и гиперхромазия, а атипичные митотические фигуры встречаются повсеместно. Эти гистологические и цитологические атипии отражают хромосомные анеуплоидии (аномальное количество хромосом) и генетическую нестабильность, которые характеризуют CIN III степени, AIS и ИРШМ. Это и есть обнаружение «геномного хаоса», который является важным этапом прогрессирования от легких степеней CIN I к CIN II/III тяжелой степени. Генетически лабильные поражения способны прогрессировать из-за повышения вероятности приобретения дальнейших мутаций генов хозяина, что может привести к ИРШМ.
Каким же образом ВПЧ-инфекции высокого риска могут способствовать этим разительным переменам? Одним из свойств канцерогенных ДНК вирусов является способность изменять поведение нормальных клеток в культуре ткани, приводя к иммортализации (Иммортализация – свойство клеток делится бесконечно долго при сохранении зависимости от адгезии клеток к твердой подложке, наличие факторов роста и контактного ингибирования) клеток с нормальным набором хромосом. Гены Е6 и Е7 ВПЧ высокого онкогенного риска, в отличие от ВПЧ низкого риска, эффективно иммортализируют генитальные кератоциты в тканевой культуре. Индуцированную вирусом иммортализацию сопровождают анеуплоидии и кариотипические хромосомные аномалии. Эти иммортализированные клеточные линии кератоцитов при введении иммуносупрессированным мышам не образуют инвазивных опухолей, но вместо этого образуют кисты с эпителием гистологически сопоставимым с CIN III степени. Развитие инвазивного фенотипа у этих клеточных линий является редким событием, которое требует длительного пассажа культуры ткани или наличия дополнительного повреждающего фактора, такого как активированные онкогены в клетке. Временная последовательность в указанных in vitro моделях отражает события in vivo. В лонгитудинальных исследованиях течения заболевания время от обнаружения ВПЧ высокого онкогенного риска до развития CIN III степени составляло 3-5 лет, а прогрессирование до возникновения инвазивного рака занимало последующие 10-20 лет и, вероятно, лишь 30-40% CIN III степени фактически развивалось в ИРШМ.
Крайне важная роль Е6 и Е7 ВПЧ высокого онкогенного риска в цервикальном канцерогенезе имеет особое значение в связи с тем фактом, что в большинстве случаев рака шейки матки и во многих CIN III степени геном ВПЧ интегрирован в хромосомы клеток хозяина. Хотя большая часть вирусной ДНК может оказаться утраченной в процессе интеграции, гены Е6 и Е7 всегда сохраняются, а белки — экспрессируются. Масса доказательств демонстрирует, что многие из онкогенных свойств генов Е6 и Е7 ВПЧ высокого онкогенного риска, в отличие от ВПЧ низкого риска, зависят от их способности взаимодействовать с белками хозяина, чья нормальная роль заключается в негативной регуляции клеточного цикла.
Все свидетельствует о том, что наличия ВПЧ-инфекции самой по себе для развития неоплазии шейки матки недостаточно, а также о причастности клеток хозяина и кофакторов окружающей среды к прогрессированию до CIN III степени, AIS и карциномы. ВПЧ-инфицированная клетка должна дерегулировать экспрессию вирусных генов и подвергнуться дополнительным клеточным генетическим событиям. Какой из этих двух феноменов является инициирующим событием в неопластическом процессе — вопрос о первичности яйца или курицы. Может произойти интеграция вирусной ДНК, приводя к дерегуляции экспрессии Е6/Е7 либо мутации, или метилирование ДНК клетки-хозяина может произойти таким образом, что будет упразднен жесткий транскрипционный контроль дифференциации и экспрессии вирусных генов; имеются свидетельства в пользу обоих указанных механизмов.
Однако большинство CIN III степени локализовано в и вокруг трансформационной зоны (зона перехода плоского эпителия в железистый) шейки матки и связано с областями плоскоклеточной метаплазии, что наталкивает на мысль о том, что неопластическая трансформация метапластического эпителия — событие онкогенного характера. Метаплазия классически определяется как замена одного типа дифференцированных клеток другим, однако плоский эпителий, возникший в процессе метаплазии, не тождественен нативному эпителию. Различия между нативным и метапластическим эпителием особенно заметны при незрелой метаплазии — это пролиферативный, но не полностью дифференцированный эпителий.
Все это становится актуальным, когда рассматривают, каким образом ВПЧ инфицирует базальные кератоциты. Появляются доказательства того, что ВПЧ-инфекции неспособствуют микроссадины генитального эпителия, что приводит к эпителиальной денудации при сохранении эпителиальной базальной мембраны (БМ). ВПЧ первоначально взаимодействует с этой обнаженной БМ с помощью первичных рецепторов в L1, связываясь и проникая в кератоцит предположительно до того, как кератоцит мигрирует по БМ к реэпителизируемой маленькой ранке. Более тонкий и уязвимый метапластический эпителий может оказаться более восприимчивым к микроповреждающему процессу и, следовательно, к ВПЧ-инфекции. Теоретически можно предположить, что метапластический эпителий, особенно незрелый метапластический эпителий, лишь частично пермиссивный в отношении ВПЧ, является резервом легко инфицируемых клеток и в то же время — пермиссивным для экспрессии ранних генов и репликации вирусной ДНК, но не для процессов синтеза белков капсида и вирусной сборки, которые, по-видимому, все-таки зависят от конечной дифференциации кератоцитов. Кроме того, инфицирование резервных клеток, вовлеченных в железистую дифференциацию, приводит к незавершенному жизненному циклу вируса, поскольку ВПЧ нуждается в полностью дифференцированном плоском эпителии для воспроизводства и высвобождения вирусов.
Выявление ВПЧ в качестве этиологического фактора развития рака шейки матки имеет значение в отношении скрининга по выявлению злокачественных новообразований. Цервикальный цитологический скрининг высокоэффективен для вторичной профилактики во многих развитых странах, но появление и внедрение профилактических вакцин против ВПЧ будет оказывать влияние на скрининг. Скрининг будет осуществляться как в отношении вакцинированных, так и невакцинированных групп, поскольку мишенью современных вакцин является лишь ВПЧ 16-го и 18-го типов. Однако можно прогнозировать, что протоколы скрининга будут меняться и будут основываться на обнаружении ВПЧ (и, вероятно, типировании) как первой линии скринингового обследования с применением цитологического исследования в качестве мероприятия по сортировке пациентов. Показано, что анализ на наличие ВПЧ неизменно превосходит цитологическое исследование в отношении чувствительности и прогностической ценности положительного результата в развитых странах, а в недавнем исследовании, проведенном в сельских районах Индии, однократный анализ на наличие ВПЧ с последующим лечением был связан со значительным сокращением количества случаев рака шейки матки на поздней стадии и смертей от этой патологии. Это знаковое исследование, которое недвусмысленно показывает, что вторичные вмешательства — как цитологическое исследование, так и обнаружение ВПЧ, сокращают количество новых случаев и снижают уровень смертности от ИРШМ, однако анализ на наличие ВПЧ оказывается эффективнее.
Согласно данным эпидемиологических исследований, в последние десятилетия в мире отмечается...
Внутриутробные инфекции (ВУИ) – это инфекционные процессы, вызванные возбудителями,...
Вирусный гепатит С (ВГС) — одна из актуальных проблем современного здравоохранения. Это...
С началом выполнения скрининговых программ для выявления рака шейки матки (РШМ) заболеваемость...
Злокачественные новообразования – это группа заболеваний, которых насчитывается более...
анализы, БАД, биологическая медицина, витамины, гастроэнтерология, гигиена, гинекология, гомеопатия, дерматология, диагностика, диетология, заболевания, иммунология, инфекционные заболевания, инфекция, исследования, кардиология, кожа, косметика, красота, лекарственные растения, лечение, лицо, неврология, обследование, оздоровление, онкология, ортопедия, педиатрия, питание, пищеварительная система, поведение, похудение, препараты, продукты, профилактика, процедура, психология, пульмонология, рак, реабилитация, сердечно-сосудистая система, ССС, тело, терапия, травматология, уход, фитотерапия, хирургия, эндокринология
Показать все теги

Комменатрии к новости