Ранняя диагностика колоректального рака
Согласно данным эпидемиологических исследований, в последние десятилетия в мире отмечается...
Медицина / Диагностика / Диагностика (статья)
 HPVС началом выполнения скрининговых программ для выявления рака шейки матки (РШМ) заболеваемость и смертность, связанные с этим заболеванием, резко снизились. Такие методики, как традиционный мазок по Папаниколау и более новая методика жидкостной цитологии дают возможность выявить патологически измененные клетки шейки матки на ранних стадиях – а до их перерождения в инвазивный рак шейки матки. В связи с тем, что инфицирование онкогенными типами папилломавируса человека (HPV или ВПЧ) является пусковым фактором развития рака шейки матки, также предложено использовать определение ДНК HPV в качестве рутинного метода скрининга всего населения.
HPVС началом выполнения скрининговых программ для выявления рака шейки матки (РШМ) заболеваемость и смертность, связанные с этим заболеванием, резко снизились. Такие методики, как традиционный мазок по Папаниколау и более новая методика жидкостной цитологии дают возможность выявить патологически измененные клетки шейки матки на ранних стадиях – а до их перерождения в инвазивный рак шейки матки. В связи с тем, что инфицирование онкогенными типами папилломавируса человека (HPV или ВПЧ) является пусковым фактором развития рака шейки матки, также предложено использовать определение ДНК HPV в качестве рутинного метода скрининга всего населения.
Ограничения, связанные со степенью соблюдения руководств по скринингу, чувствительностью и специфичностью диагностических тестов, доступом к медицинской помощи в рамках скрининга, а также эффективностью затрат, отражены в современных руководствах по скринингу рака шейки матки. Создание профилактических вакцин является ключевым событием в деятельности по предупреждению развития этого злокачественного новообразования. Такие вакцины защищают от первичного инфицирования определенными онкогенными типами HPV и, таким образом, предотвращают развитие дисплазии, предраковых очагов и РШМ. Учитывая рутинное проведение вакцинации для профилактики рака шейки матки среди девочек-подростков, руководства по скринингу необходимо адаптировать к новым условиям для того, чтобы сохранить эффективность (в том числе экономическую) мер, направленных на предупреждение этого заболевания. Хотя сразу оценить истинное эпидемиологическое и экономическое значение вакцинации в профилактике рака шейки матки невозможно, математические модели позволяют прогнозировать различные сценарии, при которых проведение вакцинации в дополнение к скрининговым обследованиям шейки матки будет экономически эффективным и обеспечит дальнейшее снижение частоты случаев рака шейки матки.
Инвазивный рак шейки матки занимает второе место среди наиболее распространенных видов злокачественных новообразований у женщин во всем мире, при этом ежегодно диагностируют около 500000 новых случаев данного заболевания и регистрируют более 270000 смертей. В связи с проведением скрининговых программ для выявления рака шейки матки на протяжении последних 40 лет заболеваемость этим видом рака и смертность от него в промышленно развитых странах резко снизились. В США до 1950 г. инвазивный рак шейки матки являлся основной причиной смерти от злокачественных новообразований среди женщин. В период с 1955 г., когда в США начали проводить скрининговые обследования, по 1992 г. число случаев смерти от рака шейки матки снизилось на 74%, и в настоящее время уровень смертности продолжает снижаться. Подобная тенденция также наблюдалась в других промышленно развитых странах, в том числе и в Соединенном Королевстве (рис. 1). Данное снижение уровня смертности, связанной с раком шейки матки, в основном обусловлено большей частотой выполнения мазков по Папаниколау (Пап-тестов) в целях выявления рака шейки матки на ранних стадиях и предраковых очагов в шейке матки.
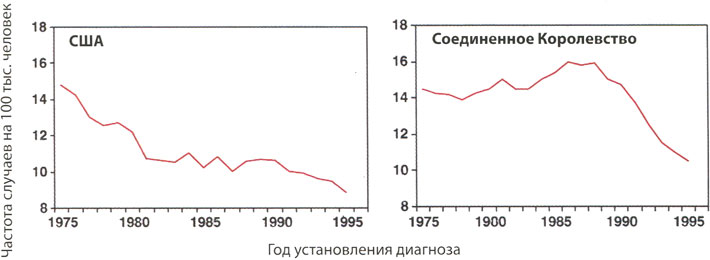
Рис. 1. Заболеваемость раком шейки матки и Соединенном Королевстве, 1975-1995 гг.
Поразительно высокая эффективность скрининга для выявления рака шейки матки отчасти связана с характером течения патологических процессов, предшествующих РШМ, благодаря чему это заболевание успешно поддается вторичной профилактике. Однако серьезные проблемы остаются, включая определение оптимальных подходов к повышению как чувствительности, так и специфичности скрининговых методов для выявления рака шейки матки, выбор способов подготовки руководств по скринингу, которые будут и эффективными, и осуществимыми на практике. И, что наиболее важно, необходимо выработать подходы к обеспечению адекватного скрининга всех женщин.
Внедрение обширной скрининговой программы с использованием Пап-теста среди всего населения способно привести к снижению риска развития рака шейки матки на 60-90% в течение 3 лет. В странах, где достигли высокой степени участия населения в программе скрининга РШМ, а также обеспечили контроль качества выполнения скрининговых обследований, заболеваемость раком шейки матки и смертность снизились более чем на 50% (см. рис. 1). В Англии частота случаев инвазивного рака шейки матки находилась на неизменном уровне до тех пор, пока в 1988 г. не была внедрена качественно спланированная программа скрининга, результатом которой стало снижение уровня заболеваемости и смертности от РШМ примерно на 50%. Подобную тенденцию наблюдали в Норвегии непосредственно после внедрения в 1995 г. национальной программы по скринингу рака шейки матки с использованием цитологического исследования шейки матки. В странах, где отсутствует программа скрининга на уровне всего населения, частота случаев развития РШМ обычно настолько не снижалась.
Тест по Папаниколау — цитологическое исследование мазков, полученных из шейки матки, является золотым стандартом в истории скрининга на рак шейки матки. Пап-тест позволяет выявлять бессимптомные изменения эпителия шейки матки, что обеспечивает обнаружение большего процента случаев злокачественных новообразований на ранних стадиях неопластического процесса.
При условии прохождения регулярного скрининга возможны ранняя диагностика и лечение предраковых очагов (цервикальной интраэпителиальной неоплазии (CIN), что способствует снижению уровня заболеваемости РШМ. Проведение скрининга также позволяет снизить связанную с раком шейки матки смертность, поскольку среди пациенток с ранней стадией этого злокачественного новообразования отмечен высокий уровень выживаемости (приблизительно 90% при стадии I по сравнению с 75% при стадии II, 50% при стадии III и 20-30% при стадии IV). В США использование Пап-теста способствовало непрерывному снижению смертности от рака шейки матки приблизительно на 4% в год. Хотя эффективность скрининга никогда не была доказана в каком-либо рандомизированном исследовании, о наличии его благоприятных эффектов свидетельствует прямая зависимость между процентом населения, которому провели скрининговое обследование с использованием Пап-теста, и снижением заболеваемости РШМ и смертности от этого заболевания.
Снижения уровня заболеваемости и смертности от рака шейки матки в США и других промышленно развитых странах удалось достигнуть несмотря на относительно низкую чувствительность традиционного цитологического исследования. Результаты метаанализов указывают на то, что чувствительность одного традиционного Пап- теста для выявления CIN 2/3-й степени и выше составляет 50-60% . Низкая чувствительность Пап-теста обусловлена комбинацией факторов: некачественным сбором образцов материала (5-10% из всех стекол), неправильной подготовкой стекол и ошибками лаборатории при их интерпретации.
Метод жидкостной цитологии (ЖЦ) в первую очередь был разработан для повышения эффективности традиционного Пап-теста, а также для улучшения качества образцов материала из шейки матки. Особенностью метода ЖЦ является наличие жидкой среды, которая предназначена для сохранения клеточного материала, полученного из шейки матки. Впоследствии взвесь клеток обрабатывают для получения более однородного, тонкого слоя клеток шейки матки с меньшим количеством клеточного дебриса на предметном стекле. Цель этого процесса — потенциально снизить частоту возникновения двух основных недостатков, которые отмечаются при выполнении традиционного цитологического исследования: получения относительно небольшого и потенциально нерепрезентативного образца клеток (в действительности только около 20% полученных клеток переносятся на стекло), а также влияния других видов материала, в том числе слизи, крови и других клеток (не из шейки матки), на возможность интерпретации микропрепарата.
В нерандомизированных исследованиях были отмечены уменьшение количества стекол неудовлетворительного качества в случае применение метода ЖЦ, а также более высокая или аналогичная чувствительность при выявлении патологии шейки матки по сравнению с традиционным цитологическим исследованием. Однако эти преимущества не были установлены в большинстве рандомизированных исследований.
В наибольшем на сегодняшний день рандомизированном исследовании итальянские ученые распределили 22 708 женщин (в возрасте от 25 до 60 лет) в группу проведения ЖЦ и 22 466 женщин в группу традиционного цитологического исследования. По сравнению с обычным методом цитологического исследования метод ЖЦ позволил выявить большее количество случаев CIN 1-й степени при последующем патогистологическом исследовании, но не CIN 2-й и более высокой степени, когда в качестве пороговых показателей, служивших показанием к проведению кольпоскопии, использовали атипичные клетки плоского эпителия неустановленной значимости (ASCUS) и плоскоклеточные интраэпителиальные поражения шейки матки низкой степени (LSIL). Общее положительное прогностическое значение ЖЦ для всех конечных точек, представленных CIN, было статистически значимо меньше по сравнению с таковым для традиционного цитологического исследования, что привело к более высокой частоте проведения кольпоскопий для одинакового количества диагностированных клинически значимых очагов.
Однако в недавно выполненном рандомизированном исследовании (n=13,484) установили, что метод ЖЦ позволил выявить большее количество патологических очагов высокой степени по сравнению с традиционным Пап-тестом. После проведения патогистологического анализа идентифицировали приблизительно на 42% больше патологически измененных очагов высокой степени в результате использования метода ЖЦ по сравнению с Пап-тестом (1,20% по сравнению с 0,85%, Р=0,05). Во всех указанных рандомизированных исследованиях применение ЖЦ обеспечило статистически значимое уменьшение количества образцов материала неудовлетворительного качества.
Хотя имеется множество потенциальных причин таких расхождений, вполне возможно, что метод ЖЦ в большей степени устойчив к вариациям методик, применяемых для получения образцов материала, которые типичны для медицинских лабораторий. Основаниями для перехода на метод ЖЦ являются высокая частота проведения повторных тестов (преимущественно обусловленная получением образцов материала неудовлетворительного качества посредством традиционного Пап-теста), а также более высокая способность автоматизации процесса приготовления и исследования образцов материала в условиях перегруженности и нехватки персонала лабораторий. Исходя, главным образом, из необходимости повторного взятия мазков, отмеченной в ранее проводимых нерандомизированных исследованиях с применением традиционного метода цитологического исследования, метод ЖЦ был внедрен и канадской, и британской системой здравоохранения.
Другим явным преимуществом метода ЖЦ является использование жидкости с клетками для проведения других диагностических тестов, в том числе теста на определение HPV онкогенного типа в рамках или сочетанного скринингового обследования (оба теста выполняются одновременно), или «ответного» HPV-тестирования (reflex testing; тест на определение HPV проводится только в случае получения определенных результатов цитологического исследования). Однако следует отметить, что комбинация цитологического исследования и теста на определение HPV могут не привести в результате к существенной клинической пользе, особенно при выполнении их у женщин более молодого возраста.
Предстоит еще установить отдаленное влияние ЖЦ на уровень заболеваемости и смертности, связанных с раком шейки матки, равно как и экономическую эффективность этого метода. Поскольку метод ЖЦ более дорогой по сравнению с традиционным цитологическим исследованием и требует дополнительного инструментария для приготовления мазков, в условиях ограниченных ресурсов его внедрение может оказаться неосуществимым.
Согласно последним данным, в настоящее время в США 24,9 млн женщин в возрасте от 14 до 59 лет инфицированы вирусом HPV. Идентифицировано около 100 типов этого вируса, из них 40 типов поражают слизистую оболочку половых органов. Предполагается, что более 80% женщин будут поражены генитальной папилломавирусной инфекцией к 50-летнему возрасту. Из 40 типов HPV, поражающих половые органы, 15 типов считаются онкогенными или связанными с высоким риском развития злокачественного новообразования. В настоящее время достоверно установлено, что инфицирование онкогенными типами HPV является пусковым фактором развития РШМ. При этом причинная связь между папилломавирусной инфекцией и инвазивным РШМ наиболее сильна в отношении онкогенных типов 16 и 18.
Поскольку инфекция, вызванная онкогенными типами HPV, является основной причиной развития РШМ, в настоящее время обсуждается использование определения HPV в качестве первоочередного скринингового теста для выявления РШМ. Установлено, что тест на определение ДНК-канцерогенных типов HPV, ассоциированных с развитием РШМ, статистически значимо более чувствительный по сравнению с цитологическим исследованием для выявления CIN, а также характеризуется большей воспроизводимостью и позволяет получить объективный результат. Таким образом, обладая большей чувствительностью, тест для определения папилломавирусной ДНК восполняет основной недостаток, свойственный и стандартному методу цитологического исследования, и методу ЖЦ.
В рандомизированных исследованиях установили, что определение HPV в сочетании со стандартным цитологическим исследованием имеет большую чувствительность, но меньшую специфичность по сравнению с одним цитологическим исследованием как для ведения пациенток с ASCUS, так и при первичном скрининге. Что касается первичного скрининга, то меньшая специфичность тестирования на наличие папилломавирусной ДНК является особенно важным аспектом. В связи с тем, что у значительного процента женщин, у которых выявили ДНК HPV, отсутствует патология шейки матки, небольшое снижение чувствительности диагностического метода может привести к увеличению числа женщин с ложноположительными результатами. Без изменений в интервалах между скрининговыми обследованиями это может привести к увеличению как времени, так и затрат на наблюдение пациенток.
Одним из ограничений цитологического исследования и имеющихся на сегодняшний день тестов для определения HPV является то, что большинство выявленных патологических очагов и/или случаев HPV-инфекции никогда не разовьются в более серьезные очаги дисплазии высокой степени или в инвазивный рак шейки матки. Высокоприоритетной задачей остается определение методов, которые позволят выяснить, какие женщины с результатами теста, свидетельствующими о наличии патологии, действительно находятся в группе риска развития неоплазии высокой степени или инвазивного рака, а каким женщинам можно с уверенностью назначить консервативную тактику ведения. Имеется доказательство того, что некоторые специфичные HPV- генотипы обуславливают заметно больший риск развития нового случая CIN 2-й или более высокой степени. Оценка чувствительности и специфичности теста для определения каждого отдельного типа HPV высокого риска не проводилась, однако в настоящее время тесты для типоспецифического анализа на рынке отсутствуют.
Пациентам, врачам и организаторам здравоохранения необходимы инструменты, которые помогут оценить последствия при внедрении новых технологий для проведения скрининга среди населения в связи с необходимостью соблюдения оптимального соотношения между результатами, достигнутыми в отношении здоровья (такими как пропущенный или запоздалый диагноз злокачественного новообразования и диагностирование и лечение доброкачественных очагов), финансовыми затратами и различиями между чувствительностью и специфичностью, а также периодичностью скрининговых обследований. В случае профилактики рака шейки матки для решения этой задачи чаще всего используют математическое моделирование.
Данные математических моделей свидетельствуют, что скрининг всего населения с использованием Пап-теста, проводимый через каждые 3 года, обеспечивает снижение частоты развития инвазивного рака шейки матки на 91%, а через каждые 5 лет — на 84%. В Северной Америке и Европе внедрение скрининговых программ для выявления РШМ ассоциировалось со снижением смертности, связанной с РШМ, на 20-60%.
«Эффективность затрат» с точки зрения экономики является относительным показателем; можно говорить об эффективности затрат для той или иной скрининговой стратегии только при сравнении ее с другой стратегией. Большинство достижений в здравоохранении приводят как к улучшению результатов в отношении здоровья, так и к увеличению затрат в этой области. Это, вне всякого сомнения, применимо и к скринингу для выявления злокачественных новообразований. Учитывая ограниченность ресурсов, вопрос, как правило, заключается не в том, требует ли больших затрат стратегия с лучшими исходами по сравнению с альтернативной стратегией, главный вопрос — оправданы ли эти дополнительные затраты. В США затраты на медицинскую помощь в рамках наблюдения пациенток с патологией по результатам цитологического исследования, обусловленной HPV-инфекцией, и на лечение предраковых очагов достигают $4 млрд ежегодно. Таким образом, определение более эффективных стратегий, безусловно, является одной из приоритетных задач.
Чаще всего при проведении анализа в экономике здравоохранения показателем сравнения служит коэффициент эффективности дополнительных затрат — ICER (incremental cost-effectiveness ratio). Он рассчитывается путем деления разницы в затратах на реализацию двух сравниваемых стратегий на разницу в результатах, достигнутых в отношении здоровья. Обычно оценкой результата является различие в продолжительности жизни или, в идеальном случае, ожидаемое количество лет качественной жизни (quality adjusted life expectancy), выраженное сохраненными годами жизни или сохраненными годами качественной жизни (QALY). Как правило, в США скрининговая стратегия считается экономически эффективной, если показатель ICER находится в диапазоне от $50 до $80 тыс. на каждый сохраненный год качественной жизни.
В случае с профилактикой РШМ прямое сравнение различных скрининговых стратегий является невозможным в связи с ограничениями практического и этического характера. Оценки эффектов в отношении здоровья и экономических эффектов, обусловленных различными скрининговыми стратегиями, обычно получают при помощи компьютерных имитационных моделей. Несмотря на применение различных компьютерных программ, на едва уловимые различия в структуре моделирования, перемены в области технологий и затрат, а также изменения в нашем представлении о течении РШМ, результаты, полученные за последние 30 лет в исследованиях с использованием моделей, являются в высшей степени последовательными.
В связи с повышением частоты проведения скрининговых обследований возрастает и показатель ICER — при ежегодном скрининге он составляет более $100 тыс., что гораздо больше по сравнению со скринингом, проводимым 1 раз в два года. Предотвращение относительно небольшого количества случаев рака шейки матки и смерти от этого злокачественного новообразования при ежегодном скрининге, по сравнению с проводимым 1 раз в два года скринингом, достигается за счет проведения большого количества дополнительных тестов, получения ложноположительных результатов и диагностирования патологических очагов, прогрессирование которых до злокачественного новообразования маловероятно. При неизменной периодичности скрининговых обследований величина ICER увеличивается при уменьшении специфичности диагностического теста, поскольку затраты на дальнейшую диагностику и оценку результатов в случае ложноположительных тестов не приводят к улучшению результатов в отношении здоровья (и потенциально ухудшают качество жизни с учетом тревоги, которую пациенты часто испытывают при получении результатов тестов, свидетельствующих о патологии). Величина ICER также возрастает при повышении чувствительности диагностического теста, поскольку многие из дополнительно выявленных патологических процессов представляют собой очаги, которые не прогрессируют до злокачественного новообразования. Это влияние чувствительности и специфичности на величину ICER становится более выраженным при повышении частоты выполнения диагностических тестов.
В дополнение к периодичности скрининговых обследований важным фактором в определении эффективности скрининговой программы является возраст, в котором женщина начинает принимать участие в скрининге. Среди женщин, у которых первый половой контакт произошел в более молодом возрасте, отмечена высокая частота случаев HPV-инфекции, а также ассоциированных с ней доброкачественных изменений в шейке матки. Следовательно, существует очень высокая вероятность обнаружения, диагностирования и лечения изменений в шейке матки, которые никогда не разовьются в злокачественное новообразование. Дополнительно имеются доказательства того, что многие очаги CIN 2 в этой возрастной группе на самом деле не являются предраковыми очагами с выраженным потенциалом к прогрессированию до инвазивного рака шейки матки. Агрессивное лечение при этих патологических очагах к тому же увеличивает риск последующих неблагоприятных исходов беременности и родов. У женщин старше 65 лет скрининг также не имеет достаточной эффективности, особенно в тех случаях, когда результаты недавно пройденных скрининговых тестов свидетельствуют об отсутствии патологии, поскольку заболеваемость РШМ в этой возрастной группе является невысокой.
Понимание сути проблемы благодаря моделированию оказалось чрезвычайно полезным для нахождения главного компромисса с целью сохранить оптимальный баланс между частотой прохождения скрининговых обследований, характеристиками диагностических тестов и возрастом для участия в скрининге. Однако исторически сложившееся нежелание сделать выбор в пользу меньшей периодичности скрининговых обследований в США в большей части обусловлено проблемами доступа к медицинской помощи и степени соблюдения руководств по скринингу. Риск развития РШМ в 2-10 раз выше среди тех женщин, которые никогда не принимали участия в скрининге. Кроме того, такой риск возрастает в зависимости от длительности периода со времени последнего скринингового обследования шейки матки. В США более 50% женщин с РШМ никогда не проходили скринингового обследования для выявления данного заболевания, а 60% не принимали участия в скрининге на протяжении последних 5 лет. Статистически значимые различия в показателях заболеваемости РШМ и смертности существуют в определенных этнических группах, а также в случае разных уровней образования и доходов. Эти различия в основном связаны с уровнем доступа к медицинской помощи в рамках скрининга и степенью использования тех или иных медицинских услуг.
Имеющиеся в настоящее время руководства по скринингу на рак шейки матки представлены в табл. 1. В них также рассмотрены вопросы, которые обсуждались выше, в том числе затраты на медицинскую помощь и их эффективность. Хотя для разных групп населения могут быть некоторые различия в определенных рекомендациях, общепризнанным является тот факт, что не существует оптимального соотношения между чувствительностью и специфичностью диагностического теста, возрастом для начала участия в скрининге, частотой прохождения скрининговых обследований и степенью доступа к медицинской помощи, степенью соблюдения требований руководств, а также уровнем эффективности затрат.
|
Характеристика |
Руководство Американского общества (American Cancer Society, ACS) |
Руководство Рабочей группы по профилактической медицине, США (US Preventive Services Task Force, USPSTF) |
Руководство Американского колледжа акушеров и гинекологов (American College of Obstetricians and Gynecologists, ACOG) |
|
Начало участия в скрининге |
Принимать участие в скрининге начинают в возрасте 21 года либо через 3 года после сексуального дебюта (в зависимости от того, что происходит первым) |
Принимать участие в скрининге начинают в возрасте 21 года либо через 3 года после сексуального дебюта (в зависимости от того, что происходит первым) |
Принимать участие в скрининге начинают в возрасте 21 года либо через 3 года после сексуального дебюта (в зависимости от того, что происходит первым) |
|
Периодичность скрининговых обследования |
|||
|
Ежегодный скрининг |
Женщины <30 лет |
Данные не применимы |
Женщины <30 лет |
|
Каждые 2-3 года |
Женщины ≥30 лет: - выполнение традиционного Пап-теста при условии предшествующего прохождения 3 последовательных скрининговых обследований с результатами, свидетельствующими об отсутствии патологии шейки матки; - выполнение цитологического исследования по методу ЖЦ при условии предшествующего прохождения 3 последовательных скрининговых обследований с результатами, свидетельствующими об отсутствии патологии шейки матки. |
Данные не применимы |
Женщины ≥30 лет: - выполнение традиционного Пап-теста при условии предшествующего прохождения 3 последовательных скрининговых обследований с результатами, свидетельствующими об отсутствии патологии шейки матки; - выполнение цитологического исследования по методу ЖЦ при условии предшествующего прохождения 3 последовательных скрининговых обследований с результатами, свидетельствующими об отсутствии патологии шейки матки. |
|
Каждые 3 года |
Женщины ≥30 лет: - цитологиеское исследование по методу ЖЦ в сочетании с HPV-тестированием в случае, если и результаты ДНК-тестирования для определения HPV, и результаты цитологического исследования указывают на отсутствие патологии шейки матки. |
Проведение или традиционного Пап-теста, или цитологического исследования по методу ЖЦ через 3 года после первого полового контакта или возрасте 21 года. |
Женщины ≥30 лет: - цитологиеское исследование по методу ЖЦ в сочетании с HPV-тестированием в случае, если и результаты ДНК-тестирования для определения HPV, и результаты цитологического исследования указывают на отсутствие патологии шейки матки. |
|
|
|||
Если не учитывать потенциальных последствий профилактической вакцинации против HPV, применение скрининга в качестве метода профилактики рака шейки матки сопряжено с некоторыми проблемами. Из них наиболее важными представляются те, которые заключаются в определении способов повышения степени участия в скрининговых программах и степени соблюдения требований руководств по скринингу. Также важно определить, можно ли в скрининг включить применение более чувствительных, но менее специфических тестов, в частности, пересмотрев длительность интервалов между скрининговыми обследованиями. Другой проблемой является разработка доступных методов для определения женщин, которые действительно находятся в группе риска развития рака шейки матки. Внедрение эффективных профилактических вакцин против HPV повлияет на эти три основные направления.
Разработаны две профилактические вакцины, которые защищают от развития предраковых очагов и инвазивного рака шейки матки; для одной из вакцин недавно получено регистрационное свидетельство в США (Gardasil®; Merck & Co., Whitehouse Station, шт. Нью-Джерси), для другой регистрационное свидетельство в США ожидали получить в 2008 г. (Cervarix®; GlaxoSmithKline, Rixensart, Бельгия). Обе вакцины защищают от инфицирования онкогенными HPV-типами 16 и 18, которые обуславливают большую часть (около 77%) всех случаев РШМ и более 50% случаев интраэпителиальных очагов дисплазии высокой степени в Северной Америке. Гардасил® также защищает от возникновения инфекции, обусловленной HPV-типами 6 и 11, которые главным образом ассоциированы с развитием генитальных кондилом. В связи с тем, что эти вакцины начинают применять там, где скрининг среди населения уже проводится, необходимо дать оценку краткосрочного и долгосрочного влияния вакцинации на результаты в отношении здоровья и экономики здравоохранения.
Подобно данным моделей по оценке скрининга для выявления патологии шейки матки качественные данные опубликованных исследований с использованием моделей для изучения влияния НРУ-вакцин на скрининг РШМ носят также последовательный характер. При условии формирования пожизненного иммунитета и стоимости вакцины, соответствующей текущему уровню цен, вакцинация является эффективной с точки зрения затрат (ICER — $75 000 и меньше на 1 QALY для США) при проведении скрининга среди населения, особенно в случае увеличения интервалов между скрининговыми обследованиями. Проведение вакцинации может также способствовать компенсации двух основных недостатков современных скрининговых программ, связанных с возрастом, в котором необходимо начинать прохождение скрининга, и частотой скрининговых обследований. Результаты исследования с использованием моделей показали, что в группе вакцинированных лиц выполнение скрининга можно начинать позднее и с меньшей периодичностью обследований. При этом результаты в отношении здоровья будут равноценными или лучше, а затраты — ниже по сравнению с группой лиц, не прошедших вакцинацию. Вакцинация также может обеспечить решение проблем, связанных с уровнем доступа к медицинской помощи, предусмотренной скрининговой программой, и соблюдением требований руководств по скринингу. Теоретически обеспечение широкого охвата населения при проведении вакцинации, особенно в целевых возрастных группах, должно быть более простой задачей, чем обеспечение постоянного уровня участия в скрининговых программах и соблюдения рекомендаций по скринингу в течение жизни. Однако если существует вероятность того, что прошедшие вакцинацию женщины не будут придерживаться рекомендаций по скринингу в связи с убеждением о полной защите от рака шейки матки, результаты в отношении здоровья могут в действительности ухудшиться.
Экономическая эффективность вакцинации для защиты от рака шейки матки зависит от многих пока еще не установленных параметров, самые главные из них — длительность обеспечиваемой защиты, а также стоимость и необходимость введения бустерных доз вакцины.
В одном исследовании, в котором проводили сравнение скрининговых стратегий с проведением вакцинации и без нее (с допущением 90% эффективности вакцины) в различных возрастных категориях, установили, что проведение вакцинации лицам в возрасте 12 лет с условием проведения скрининговых обследований один раз в три года, начиная с 25-летнего возраста, представляло собой наиболее экономически эффективную стратегию, при этом показатель ICER составил менее $60 тыс. на 1 QALY, а риск развития рака шейки матки на протяжении всей жизни снизился на 94% по сравнению со стратегией без проведения вакцинации. В дополнительном модельном исследовании сравнивали проведение только вакцинации или только цитологического исследования с проведением вакцинации и последующим скринингом с различной периодичностью. Результаты показали, что проведение вакцинации в 12-летнем возрасте с периодичностью скрининга один раз в два года, начиная с 24 лет, представляло собой более привлекательную экономически эффективную стратегию (ICER — $44,889 на 1 QALY) по сравнению со стратегиями, заключавшимися в проведении вакцинации в сочетании со скринингом 1 раз в два года, начиная с 18 лет, или проведении только скрининга 1 раз в два года, начиная с 18 лет. В данном анализе установили, что возможность реализации эффективных скрининговых стратегий зависела от адекватного уровня защиты, обеспечиваемого вакцинацией на протяжении всего возрастного периода, на который припадает максимальное количество случаев HPV-инфекции высокого онкогенного риска.
Следует учитывать один основной фактор при разработке скрининговых стратегий для применения у женщин, прошедших вакцинацию. Хотя имеющиеся вакцины не защищают от всех онкогенных типов HPV, частота случаев HPV-инфекции и, следовательно, распространенность предраковых очагов будет статистически значимо снижаться. Это означает, что отрицательное прогностическое значение любого скринингового теста возрастет, а положительное прогностическое значение — уменьшится. В случае если интервалы между скрининговыми обследованиями не будут увеличены, или специфичность диагностических тестов не будет повышена, тогда абсолютное число ложноположительных результатов будет расти, обуславливая последующее неблагоприятное влияние как на результаты в отношении здоровья, так и на величину финансовых затрат. Особенно в случае скрининговых тестов с высокой чувствительностью повышение частоты ложноположительных результатов, обусловленное уменьшением распространенности HPV-инфекции, носит значительно более выраженный характер в отличие от степени снижения частоты ложноотрицательных результатов (рис. 2).
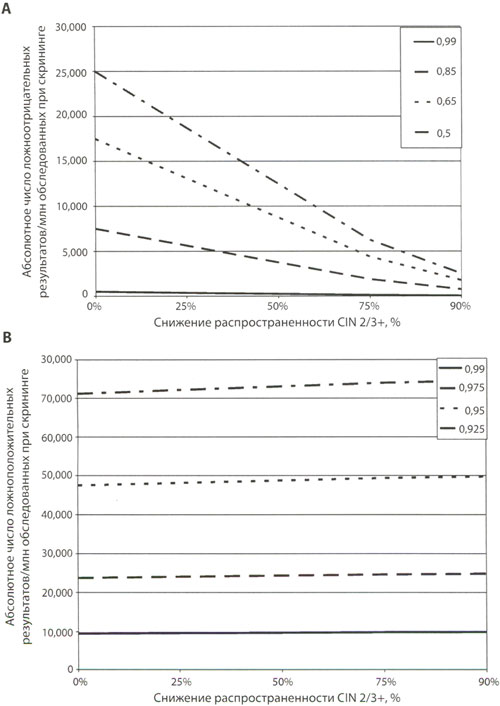
Рис. 2. Влияние снижения распространенности CIN 2/3+ в результате вакцинации на абсолютное число ложноотрицательных (A) и ложноположительных результатов (B) на 1 млн. прошедших скрининг женщин при разных уровнях чувствительности и специфичности тестов
В дополнение к вопросам о продолжительности защиты в результате вакцинации имеется ряд других факторов, которые будут влиять как на эффективность вакцинации и скрининга, так и на экономическую эффективность. Были высказаны опасения относительно возможного появления других онкогенных типов HPV в качестве ведущих факторов развития РШМ, как только типы HPV 16 и 18 в значительной степени будут элиминированы из популяции благодаря применению вакцин. Скрытые патологические очаги, которые до этого удаляли в ходе лечения более агрессивных очагов, вызванных HPV-типами 16 и 18, теперь смогут прогрессировать. Однако данные свидетельствуют о том, что обе вакцины обеспечивают частичную перекрестную защиту от онкогенных вирусных типов, генетически связанных с HPV-типами 16 и 18, что потенциально может увеличивать их общую эффективность, а также эффективность с точки зрения затрат.
В настоящее время показания к проведению вакцинации среди лиц мужского пола в США отсутствуют, поскольку данные по эффективности вакцины против HPV в этой группе пока еще не применимы. Однако результаты исследований свидетельствуют о высоком уровне сероконверсии среди мальчиков-подростков в результате вакцинации против HPV-типов 6,11, 16 и 18, а результаты по иммуногенности статистически значимо не отличаются от таковых, полученных для девочек того же возраста. Результаты, которые получат в продолжающихся в настоящее время исследованиях по безопасности и эффективности применения вакцин у мальчиков-подростков и молодых мужчин, могут стать основанием для регистрации показания к применению таких вакцин в этой категории населения, поскольку данные модельных исследований свидетельствуют о том, что вакцинация мальчиков и мужчин может обеспечить дополнительную эффективность частоты случаев HPV-инфекции.
На основании имеющихся результатов исследований на сегодняшний день проведение вакцинации показано у девочек-подростков и молодых женщин в возрасте от 9 до 26 лет. Проводимые в настоящее время исследования с участием женщин более старшего возраста (до 55 лет) могут привести к изменениям в верхней возрастной границе для проведения «наверстывающей» вакцинации или для введения бустерных доз, если обеспечиваемая вакциной защита не сохраняется на протяжении всей жизни, а также если будет доказано, что вакцинация женщин более старшего возраста является экономически эффективной на уровне всего населения. Кроме того, современные математические модели не позволяют всесторонне оценить влияние вакцинации на другие заболевания, обусловленные HPV-инфекцией 16/18 типов (таких как рак анального канала и рак ротоглотки) или 6/11 типов (таких как генитальные кондиломы и рецидивирующии папилломатоз дыхательных путей), — на заболевания, которые также характеризуются значительным бременем для здравоохранения и экономики.
Вакцинация является высокоэффективным средством для защиты от инфекций, вызванных типами HPV 16 и 18, которые являются причиной большинства случаев рака шейки матки. Руководства по проведению скрининга на РШМ в дальнейшем требуют пересмотра; в связи с тем, что становятся доступными новые технологии, целью оптимальной скрининговой стратегии должно быть сохранение равновесия между максимальным повышением эффективности за счет применения более чувствительных и специфических тестов с меньшей периодичностью скрининговых обследований и началом участия в скрининге в более позднем возрасте и минимизацией онкологического риска на уровне всего населения. Данные моделей для оценки вакцинации свидетельствуют о том, что внедрение вакцинации в структуру этих мероприятий вторичной профилактики может быть экономически эффективным, особенно если возраст прохождения скрининга и его периодичность могут быть изменены, а такой скрининг — успешно реализован. Хотя истинное влияние на эпидемиологию и уровень финансовых затрат, возможно, не удастся оценить как минимум на протяжении ближайшего десятилетия, следует ожидать резкого снижения частоты случаев предраковых очагов шейки матки, а также значительного снижения заболеваемости и смертности от рака шейки матки в долгосрочной перспективе.
Согласно данным эпидемиологических исследований, в последние десятилетия в мире отмечается...
В мире от рака молочной железы погибают примерно 600000 женщин в год. в Европе ежегодно 180000...
Вирусы папилломы человека (ВПЧ) — крупное семейство мелких вирусов, содержащих...
Злокачественные новообразования – это группа заболеваний, которых насчитывается более...
Отделение гинекологии и акушерства KORU (Турция, г. Анкара) представляет свои услуги для...
анализы, БАД, биологическая медицина, витамины, гастроэнтерология, гигиена, гинекология, гомеопатия, дерматология, диагностика, диетология, заболевания, иммунология, инфекционные заболевания, инфекция, исследования, кардиология, кожа, косметика, красота, лекарственные растения, лечение, лицо, неврология, обследование, оздоровление, онкология, ортопедия, педиатрия, питание, пищеварительная система, поведение, похудение, препараты, продукты, профилактика, процедура, психология, пульмонология, рак, реабилитация, сердечно-сосудистая система, ССС, тело, терапия, травматология, уход, фитотерапия, хирургия, эндокринология
Показать все теги

Комменатрии к новости