Эритропоэз: Гемоглобин и Эритроциты. Часть 3
Полноценный метаболизм железа – высокоорганизованный процесс, проходящий в замкнутой...
Медицина / Физиология / Физиология (статья)
 ЭритроцитПРОДОЛЖЕНИЕ. НАЧАЛО ЗДЕСЬ: Эритропоэз: Гемоглобин и Эритроциты. Часть 1
ЭритроцитПРОДОЛЖЕНИЕ. НАЧАЛО ЗДЕСЬ: Эритропоэз: Гемоглобин и Эритроциты. Часть 1
Массу эритроцитов, которая циркулирует в крови, можно сравнить с большим специализированным органом, основной задачей которого является транспорт кислорода от легких к тканям организма. Процесс удаления эритроцитами углекислого газа из тканей происходит посредством карбоангидразы. Количество эритроцитов в крови и скорость их образования в костном мозге тесно взаимосвязаны с процессом обеспечения тканей кислородом (см рисунок 10).
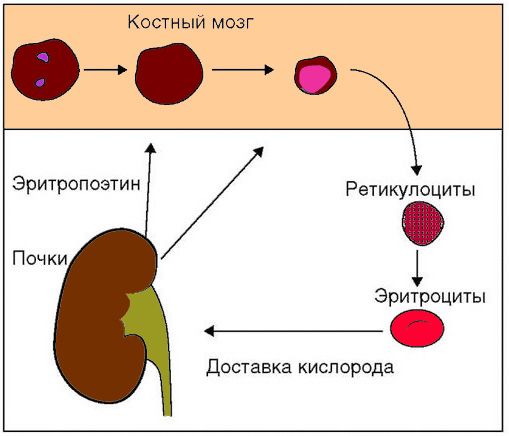
Рисунок 10. Регуляция эритропоэза
Ведущая роль эритроцитов в переносе кислорода позволяет сделать вывод, что главный фактор, влияющий на скорость эритропоэза – отношение между доставкой кислорода в ткани и метаболические потребности этих тканей.
То есть, основной стимул для продукции эритроцитов – гипоксия (дефицит кислорода в тканях). И наоборот, при увеличении количества эритроцитов в циркулирующей крови или гипероксии (чрезмерном снабжении тканей кислородом), скорость эритропоэза снижается. Долгое время ученые полагали, что фактором регуляции скорости эритропоэза является парциальное давление кислорода непосредственно в костном мозге. Такая «гипоксическая» концепция предполагала, что костный мозг даже в нормальном состоянии испытывает незначительно кислородное голодание, благодаря чему происходит стимул эритропоэза. Но непосредственное стимулирующее влияние гипоксии на продукцию клеток эритрона ученые доказать не смогли. Напротив, выяснилось, что для повышения продукции эритроцитов и высокой скорости пролиферации ядросодержащих эритроидных клеток необходимо нормальное или даже повышенное парциальное давление кислорода в костном мозге. Многолетние исследования показали, что состояние гипоксии оказывает не прямой стимул на эритропоэз, а опосредованный, с помощью эритропоэтина (ЭПО) – почечного эритропоэтического гормона (см рисунок 11).
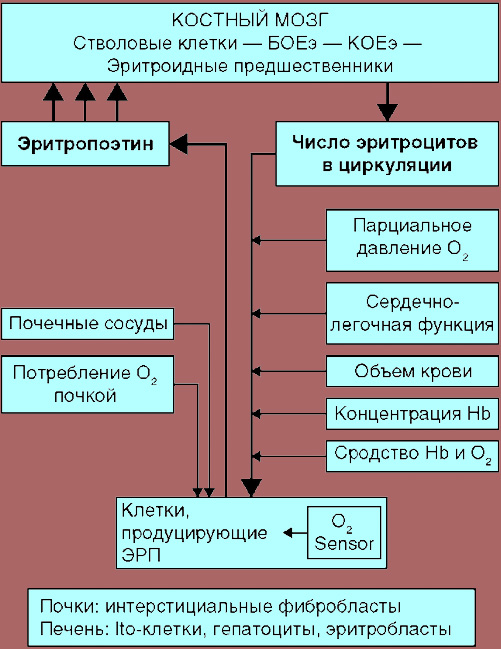
Рисунок 11. Роль эритропоэтина в регуляции эритропоэза
Уровень эритроцитов в крови зависит от координации образования и разрушения клеток эритрона. В нормальных условиях эти противоположные процессы на в состоянии стабильного динамического баланса, обеспечивающегося соответствующими регуляторными механизмами. Скорость образования эритроцитов регулируется с помощью стимулов (сигналов обратной связи), которые образую ткани, нуждающиеся в O2 (функциональная обратная связь), или сами эритроциты (обратная связь конечным продуктом).
Продукция почечного и внепочечного эритропоэтина зависит от степени гипоксической, циркуляторной, анемической и тканевой (гистотоксической) гипоксии. Уровень эритропоэтина в плазме крови может колебаться от практически нулевого (у пациентов истинной полицитемией в результате аутотрансфузирования) до 10 000 мМЕ/мл и выше (у пациентов при тяжелой гипоксии). У человека, проживающего на местности на уровне моря, нормальный уровень эритропоэтина в крови составляет примерно 10-15 мМЕ/мл; ученые полагают, что именно такая концентрация ЭПО позволяет поддерживать уровень гемоглобина в пределах 130-150 г/л, а парциальное давление кислорода в почках адекватно для синтеза эритропоэтина, чтобы обеспечить такую концентрацию. Механизм обратной связи «костный мозг – почки» обеспечивает регуляцию скорости образования эритроцитов. Регуляция синтеза эритропоэтина позволяет контролировать его концентрацию в крови в пределах 5-30 мМЕ/мл до момента, пока уровень гемоглобина в крови не уменьшается ниже 105 г/л.
При недостаточном снабжении тканей кислородом или повышение их потребностей в кислороде стимулируется синтез эритропоэтина. И наоборот – при повышенном снабжении тканей кислородом или снижением потребностей в кислороде, образование эритропоэтина ингибируется. Такой реципрокный механизм хорошо демонстрирует, что биогенез эритропоэтина определяется в первую очередь сенсорным механизмом, который взаимосвязан с аэробным метаболизмом клеток, синтезирующих ЭПО. Ответная реакция на эритропоэтин возникает в результате взаимодействия гормона с чувствительными к нему клетками-мишенями в костном мозге. Конечный эффект действия эритропоэтина – повышение количества образования клеток эритрона с целью восстановления нарушенного баланса между снабжением тканей кислородом и их потребностями в нем. То есть, эритропоэтин, выделяемый почками, выступает в роли посредника между клетками-потребителями кислорода и клетками-продуцентами гемоглобинсодержащих клеток эритрона, находящихся в костном мозге.
Ученые долгое время не могли выявить наличие эритропоэтина в крови или моче животных и людей, что было связано с отсутствием на тот момент достаточно чувствительных методов анализа. Технический и научный прогресс позволил специалистам определять и измерять количественно уровень эритропоэтина в крови и моче. Доказательства присутствия эритропоэтина не только в условиях гипоксии, но и в нормальных условиях позволили сделать вывод, что этот гормон участвует в регуляции эритропоэза и контролирует продукцию эритроцитов.
Железо (Ferrum, Fe) – один из самых распространенных металлов, уникальной особенностью которого является способность изменять свою валентность (состояние окисления и окислительно-восстановительный потенциал) в ответ на изменение состава окружающих лигандов, из-за чего этот элемент выступает в роли незаменимого компонента практически для всех живых существ на планете. Железо легко вступает в одноэлектронные окислительно-восстановительные реакции (переход из состояния Fe2+ в Fe3+). Протеины, в состав которых входит железо, являются ключевыми компонентами многих биологических процессов (транспорт кислорода, энергетический обмен, репарация и репликация ДНК, нейтрализация активных форм кислорода и других форм, которые катализируются ферментами, такими как оксигеназа, пероксигеназа и т.д.). Но эти же химические свойства железа могут оказывать на организм негативное влияние. То есть, даже незначительное количество «свободного» железа способно катализировать образование очень токсичных радикалов. Многогранность функций железа определяет его биологическую ценность, что делает этот элемент незаменимым другими металлами в сложных биохимических процессах и активном участии в клеточном дыхании, обеспечивая таким образом полноценную функцию тканей организма.
Все железозависимые и железосодержащие протеины, в зависимости от характера их взаимосвязи с биологическими элементами и с учетом их основных функций, делят на четыре группы, три из которых составляют стабильный пул железа и одна – лабильный пул железа.
Стабильный пул железа в организме человека условно делят на:
Клеточное железо содержится в основном в гемопротеинах, главным компонентом которого является гем. Гемопротеины – самая большая группа ферропротеинов, в которую входят гемсодержащие белки; эта группа включает примерно 2/3 железа, содержащегося в организме. К гемопротеинам относятся: гемоглобин, миоглобин, нейроглобин, циклооксигеназа, цитохромы дыхательной цепи (al, a3, bl, b5, c), цитохром P450, каталаза, пероксидаза (миелопероксидаза, тиреопероксидаза, лактопероксидаза) и др.
Гем – конечный продукт в цепи превращений порфирина в результате включения железа в протопорфириновое кольцо при участии феррохелатазы, чувствительной к влиянию свинца. Угнетение активности феррохелатазы нарушает процесс утилизации железа, в результате чего оно может накапливаться, вступая в связь с другими протеинами и лигандами. Белки содержаться во всех клетках организма, поэтому гем синтезируется во всех клетках, кроме эритроцитов, в которых отсутствуют протеинсинтезирующая система.
Гемоглобин содержится в эритроцитах. Его основная функция – транспорт экзогенного кислорода и эндогенного углекислого газа. Гем представляет собой конечный продукт в цепи превращений порфиринов в результате включений железа в протопорфириновое кольцо при участии феррохелатазы, чувствительной к влиянию свинца. Угнетение активности феррохелатазы нарушает процесс утилизации железа, в результате чего оно может накапливаться, вступая в связь с другими протеинами и лигандами.
Миоглобин – кислородосвязывающий протеин, участвующий в процессе клеточного, который содержится в клетках миокарда и скелетной мускулатуры. Главная функция миоглобина – транспорт кислорода в клетку и регуляция его содержания в миоцитах и кардиоцитах для обеспечения внутриклеточных метаболических процессов, лежащих в основе клеточного дыхания. Молекула миоглобина накапливает кислород и расходует с целью его компенсации в случае дефицита. В норме миоглобин не обнаруживается в крови. При разного рода поражениях мышечной ткани миоглобин из поврежденных клеток попадает в кровь и выводится с мочой.
Гемы представляют собой комплексные соединения порфиринов с 2-валентным железом, несущие 1 или 2 аксиальных лиганда. Железосодержащие ферменты негеминовой группы – следующая форма клеточного железа. Это негеминовое железо, в состав которого ходят железо-серные белки и железофлавопротеиды (негемовые ферменты митохондрий, участвующие в транспорте электронов и содержащие больше железа, чем цитохромы). К этой группе относится НАДН-дегидрогеназа, ксантиноксидаза, сукцинатдегидрогеназа, оксигеназа, липоксигеназа и специализированный железосерный протеин нуклеинового обмена рибонуклеотидредуктаза.
Неклеточное железо представлено трансферрином и лактоферрином, которые содержатся во внеклеточном пространстве и транспортируют ионы железа. Трансферрин – белок β-глобулиновой фракции плазмы крови, синтезируемый преимущественно клетками печени и лимфоидной ткани. Ежесуточно в организме здорового человека синтезируется около 12-14 г белка на 1 кг массы тела, что соответствует 5-9% от общего количества трансферрина. Лактоферрин – белок семейства трансферринов, способный транспортировать ионы 3-валентного железа.
Во внеклеточном пространстве железо находится в виде железобелковых комплексов (то есть, связано с протеинами). Концентрация железа в крови у здорового человека имеет широкий диапазон референсных значений (от 10,8 до 28,8 мкмоль/л) с довольно большими суточными колебаниями, которые могут достигать 7,2 мкмоль/л. Содержание железа в крови зависит от нескольких основных факторов: взаимоотношение процессов эритропоэза и гемолиза, а также от поступления железа в организм через желудочно-кишечный тракт. Тем не менее, главный фактор, определяющий концентрацию железа в плазме – взаимодействие эритропоэза и гемолиза.
Трансферрин – железосвязывающий белок. Общая железосвязывающая способность крови практически полностью зависит от уровня трансферрина, и варьируется у здоровых лиц в пределах 44,7-71,6 мкмоль/л, а свободная железосвязывающая способность крови, характеризуется резервной емкостью трасферрина, колеблется от 28,8 до 50,4 мкмоль/л.
Большая часть трансферрина синтезируется в гепатоцитах (паренхиматозных клетках печени). В организме человека трансферрин выполняет функции, которым уделяют особое внимание. Этот белок не только транспортирует железо в разные ткани, но и идентифицирует ретикулоциты, из которых образуется гемоглобин и, вероятно, другие клетки, нуждающиеся в железе. Эти клетки получают железо от трансферрина только при условии наличия специальных рецепторов на этих клетках (эти рецепторы связывают железо). Трансферрин также выполняет защитную функцию – предотвращает токсическое влияние железа на ткани. Одна молекула трансферрина способна связывать 2 иона 3-валентного железа, а 1 грамм трансферрина способен связать примерно 1,25 мг железа (таким образом можно вычислить общее количество железа, способного вступить в связь с трансферрином). Этот показатель позволяет дать приблизительную оценку общей железосвязывающей способности крови.
В диагностике железодефицитных состояний используется расчетная величина – процент насыщения трансферрина железом (отношение уровня железа в крови к максимальной железосвязывающей способности трансферрина крови, которое выражается в процентах). В организме здорового человека процент насыщения трансферрина железом составляет примерно 30%; в случае недостаточного поступления железа в организм этот показатель снижается.
Анализ на содержание трансферрина в крови принято использовать при дифференциальной диагностике железодефицитной анемии (ЖДА). Железодефицитная анемия характеризуется снижением уровня железа в крови, повышением концентрации трансферрина и, как следствие, снижением процента насыщения трансферрина Fe. Отметим, что у женщин уровень трансферрина в крови выше на 10%, чем у мужчин. У беременных в III триместре уровень трансферрина в крови может повышаться на 50%. У лиц пожилого возраста концентрация трансферрина в крови снижается. При воспалительных процессах в организме трансферрин проявляется в качестве белка острой фазы – при острофазном воспалительном ответе его уровень в крови снижается).
Лактоферрин – полифункциональный железосвязывающий протеин из семейства трансферринов, который присутствует во многих жидкостях организма человека (панкреатическом соке, секрете тонкого кишечника, слезах, грудном молоке, желчи, синовиальной жидкости), а также в специфических вторичных гранулах нейтрофильных лейкоцитов (образуясь в клетках миелоидного ряды со стадии промиелоцита). Лактоферрин, как и трансферрин, способен связывать два атома железа (белок состоит из одной полипептидной цепочки, приблизительная молекулярная масса – 80 000). В нормальном (здоровом) состоянии организма лактоферрин способен насыщаться железом примерно на 20%. В кровь лактоферрин попадает из нейтрофильных лейкоцитов (его концентрация в крови очень низкая). Несмотря на сходство лактоферрина с трансферрином, эти протеины отличают антигенные свойства, состав углеводов, белков и аминокислот.
Железо запаса представляет собой соединения в виде ферритина и гемосидерина, которые содержатся преимущественно в печени, селезенке и мышечной ткани. Железа запаса задействуется организмом в случае возникновения дефицита в клетках. Помимо крови, самое большое количество Fe содержится в следующих органах:
Ферритин и гемосидерин – основные соединения, содержащие запасы железа в клетке, большая часть которых находится в ретикулоэндотелиальной системе (тканевых макрофагах) печени, селезенки и костного мозга. Примерно 1/3 резервного железа в организме человека, преимущественно в виде ферритина, содержится в печени. Примерно 80% железа, содержащегося в печени связано ферритином или гемосидерином, около 5% находится в комплексе с трансферрином, 2% - с гемом, а остальная часть железа остается в лабильном пуле железа.
Резервы железа могут мобилизоваться по мере необходимости с целью компенсации потребностей организма, а также для предупреждения токсического влияния свободно циркулирующего железа.
Ферритин – гидрофильная молекула, структура которой состоит из 24 субъединиц, формирующих полую сферу, внутри которой может содержаться до 4500 атомов железа. Синтез ферритина индуцируется при высоком уровне внутриклеточного железа и ингибируется при дефиците железа. Такая регуляция опосредована системой IRE (железоответственного элемента) – IRP (железорегуляторным белком). Кроме этого, синтез ферритина регулируется цитокинами: интерферон-γ, интерлейкин-1, -6 (ИЛ-1 и ИЛ-6).
Процесс высвобождения железа происходит при деградации ферритина, что помогает мобилизовать железо для потребности клеток. В процессе деградации ферритина участвуют лизосомный и протеосомный аппараты клетки.
Гемосидерин – пигмент, представляющий собой молекулу, нерастворимый в воде, который содержится в лизосомах. Содержащееся в соединении с гемосидерином железо менее эффективно в продукции свободных радикалов и менее доступно, чем железо в соединении с ферритином.
Лабильный пул железа содержит примерно 80-90 мг Fe, которое находится в интерстициальном пространстве (межклеточных промежутках), куда оно попадает из крови. В интерстициальном пространстве железо может связываться с клеточной мембраной, а также возвращаться обратно в кровь. Существование железа лабильного пула было экспериментально установлено в исследованиях с радиоактивными изотопами Fe. Ученые предполагают, что лабильный пул сосредоточен в лимфатической система, а также депонируется в клеточной цитоплазме вне комплекса с ферритином (таблица 1).
|
Тип железа |
Концентрация железа (мг/кг) |
|
|
Мужчины |
Женщины |
|
|
Функциональное железо |
||
|
Гемоглобин |
28 |
31 |
|
Миоглобин |
4 |
5 |
|
Гемовые ферменты |
1 |
1 |
|
Негемовые ферменты |
1 |
1 |
|
Транспортное железо |
||
|
Трансферрин |
< 1 (0,2) |
< 1 (0,2) |
|
Железо запаса |
||
|
Феррин |
4 |
8 |
|
Гемосидерин |
2 |
4 |
|
Общее количество |
40 |
50 |
ПРОДОЛЖЕНИЕ ЗДЕСЬ:
Полноценный метаболизм железа – высокоорганизованный процесс, проходящий в замкнутой...
Организм человека содержит примерно 4 г железа. В норме 1-2 мг железа в сутки усваивается из...
Анемия не является заболеванием – это патологический симптом, возникающий по ряду...
Щитовидная железа локализуется в области шеи, имеет форму бабочки. Железа разделена на две...
Ferrum phos. является одной из Шусслеровых тканевых солей. Порошкообразный фосфат железа...
анализы, БАД, биологическая медицина, витамины, гастроэнтерология, гигиена, гинекология, гомеопатия, дерматология, диагностика, диетология, заболевания, иммунология, инфекционные заболевания, инфекция, исследования, кардиология, кожа, косметика, красота, лекарственные растения, лечение, лицо, неврология, обследование, оздоровление, онкология, ортопедия, педиатрия, питание, пищеварительная система, поведение, похудение, препараты, продукты, профилактика, процедура, психология, пульмонология, рак, реабилитация, сердечно-сосудистая система, ССС, тело, терапия, травматология, уход, фитотерапия, хирургия, эндокринология
Показать все теги

Комменатрии к новости