Эритропоэз: Гемоглобин и Эритроциты. Часть 2
Массу эритроцитов, которая циркулирует в крови, можно сравнить с большим специализированным...
Медицина / Физиология / Физиология (статья)
 ЭритроцитПРОДОЛЖЕНИЕ. НАЧАЛО ЗДЕСЬ:
ЭритроцитПРОДОЛЖЕНИЕ. НАЧАЛО ЗДЕСЬ:
Эритропоэз: Гемоглобин и Эритроциты. Часть 1
Эритропоэз: Гемоглобин и Эритроциты. Часть 2
Полноценный метаболизм железа – высокоорганизованный процесс, проходящий в замкнутой системе: почти все содержащееся в гемоглобине и других железосодержащих белках железо при их распаде высвобождается и вновь утилизируется (повторно используется) (см рис 12). Метаболизм железа в организме очень динамичный, несмотря на то, что ежедневно абсорбируется и выводится из организма очень малое количество этого элемента.
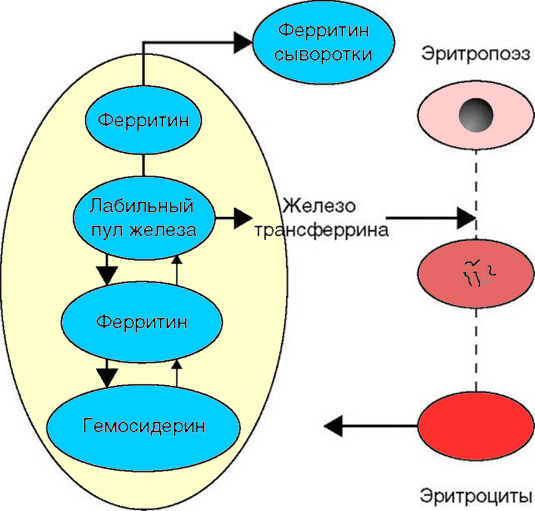
Рисунок 12. Метаболизм железа
Метаболизм железа делится на 5 фаз (этапов):
1 фаза – усвоение (всасывание) в кишечнике
2 фаза – транспорт железа в ткани
3 фаза – утилизация железа тканями
4 фаза – депонирование железа
5 фаза – выведение (экскреция) и потеря железа
Железо может усваиваться ворсинками верхнего отдела тонкой кишки в виде гема и в негемовой форме. Полноценный рацион питания должен содержать 5-10 мг железа (гемового и негемового), при этом организм усваивает только 1-2 мг. В желудке железо ионизируется, вступая в комплекс с компонентами желудочного сока. При поступлении в двенадцатиперстную кишку и проксимальный отдел тощей кишки 1-2 мг железа попадает в кровь (количество усвоенного железа также зависит от потребностей организма).
В метаболизме железа важную роль играют энтероциты – высокоспециализированные клетки эпителиального слоя двенадцатиперстной кишки, координирующие абсорбцию и транспорт железа ворсинками кишечника. Обеспечение баланса железа в организме связано с жизненным циклом энтероцитов, который начинается с родоначальных молодых клеток в крипте (кишечные крипты – углубления собственной пластинки слизистой оболочки в виде трубочек) и формирования зрелых энтероцитов на кончиках ворсинок. В энтероцитах программируется синтез новых протеинов, участвующих в процессе абсорбции, депонирование и транспорт пищевого железа.
Процесс усвоения железа регулируется протеинами энтероцитов:
1. Дуоденальный цитохром B (DcytB) – обладает феррооксидазной активностью, переводит 3-валентное железо в 2-валентное (транспертер ионов 2-валентных металлов DMT-1).
2. Ферропортин (ferroportin 1, FPN 1, гемовая оксидаза) – протеин, отвечающий за перемещение 2-валентного железа к базолатеральной мембране, откуда Fe переходит во внутренние эпителиальные клетки. Из эпителиальных клеток железо попадает в кровь или объединяется с апоферритином, образуя ферритин, который затем экскретируется из организма со спущенными клетками кишечного эпителия.
3. Гефестин с ферропортином участвуют в перемещении Fe через мембрану эритроцита, при этом окисляют железо в 3-валентное (трансферрин вступает в связь только с 3-валентным железом). Гефестин имеет сходство с медь-содержащим гликопротеином церулоплазмином, который также обладает феррооксидазной активностью и участвует в регуляции уровня экспортируемого железа из клетки в кровь (отвечает за насыщение апотрансферрина железом и преобразование его в трансферрин).
4. IRE и IRP. При избытке Fe железорегуляторный протеин не вступает в связь с железоответственным элементом, синтез рецепторов трансферрина снижается, в результате чего железо не проникает в кровь и ткани. В случае дефицита железа IRP связывается с IRE, экспрессия рецепторов трансферрина в дуоденальном крипте повышается, степень усвоения железа в увеличивается, при этом содержание дуоденального ферритина снижается. Высокий уровень содержания железа вызывает деградацию IRE и DMT (транспортер 2-валентных металлов).
5. Гепцидин (антимикробный пептид) – железорегуляторный гормон печени – пептид, обладающий антимикробными свойствами, состоящий из 25 аминокислот, образующийся в гепатоцитах (клетках печени). Гепцидин является ключевым модулятором внеклеточной концентрации железа, универсальным гуморальным регулятором метаболизма железа (отрицательный регулятор транспорта железа). При избыточном содержании железа синтез гепцидина повышается, а в случае развития анемии – снижается (при снижении уровня гепцидина увеличивается быстрый захват железа из макрофагов и медленный захват железа из кишечника).
6. Фактор высокого железа (High Fe, HFE) – трансмембранный протеин семейства белков основного комплекса гистосовместимости класса 1, который обладает способностью связывать рецепторы трансферрина с высокой аффинностью, близкой к трансферрину, тем самым блокируя возможность трансферрина вступать в соединение со своим рецептором, снижающим возможность транспорта железа к тканям.
В организм железо поступает через слизистую оболочку кишечника, адсорбируясь энтероцитами из поступившей пищи. В кишечнике постоянно происходит процесс обновления энтероцитов, которые из складок слизистой оболочки перемещаются к вершине ворсинок примерно за 24-36 часов, после чего постепенно отторгаются в просвет кишечника. То есть, суммарное время жизнедеятельности энтероцитов составляет примерно 48-72 часов. На апикальной мембране энтероцитов располагаются транспортные, регуляторные и вспомогательные белки, которые обеспечивают адсорбцию, трансформацию и перенос гема и негемового железа в клетку. Пограничная область и базальная мембрана энтероцитов – носители транспортеров и медиаторов перехода железа в кровь с участием трансферриновых рецепторов, ферропротеина и фактора высокого железа, где Fe пребывает в связанном с трансферрином транспортном комплексе. Железо, которое не экспортируется в кровь, удаляется из организма при слущиавании энтероцитов.
Процесс регуляции абсорбции железа проходит на апикальной и базолатеральной мембранах. При этом апикальная мембрана способна поглощать гем и Fe2+ из пищи и воды, а базолатеральная мембрана выступает в роли медиатора перехода Fe во внутренние эпителиальные клетки для дальнейшего его использования. Избыточное железо не экспортируется в кровь и выводится из организма при слущивании внутреннего эпителия.
Апикальная поверхность энтероцитов связывает Fe3+ из муцина с дуоденальным цитохромом B (DcytB) – ферриредуктаза, способная восстанавливать Fe3+ до Fe2+, в результате чего становится возможен транспорт железа при участии транспортера ионов двухвалентных металлов (DMT-1).
Транспортер ионов двухвалентных металлов является представителем большого семейства протеинов, способных транспортировать разные 2-валентные ионы металлов. Однако основная функция DMT-1 – трансмембранный транспорт Fe2+. В организме человека этот белок кодируется геном SLC11A2. Уровень экспрессии DMT-1 в энтероцитах крипт зависит от количества железа в организме в целом. Информация передается в энтероциты с железотрансферриновым комплексом через базолатеральную мембрану путем рецептор-опосредованного эндоцитоза. При этом программируется уровень активности энтероцита в отношении его способности к поглощению железа. Запрограммированная информация сохраняется на протяжение всего периода жизнедеятельности клетки. Вероятно, на базолатеральной мембране энтероцита находятся рецепторы свободные от железа и нагруженные металлом трансферрина, регулирующие выход и вход трансферрина соответственно. При снижении уровня внутриклеточного железа дифференцирующиеся энтероциты, которые мигрируют к вершине ворсинок, начинают усиленно синтезировать DMT-1, что приводит к усилению захвата железа. Этот процесс зависит от протеина гемохроматоза HFE.
HFE (белок гемохроматоза) у человека кодируется геном HFE, расположенного на коротком плече хромосомы 6, локусе 6p21.3. Белок, кодируемый этим геном, является мембранным протеином, способного связывать p2-микроглобулин. Ученые полагают, что этот протеин контролирует процесс усвоения железа в кишечнике путем взаимодействия рецепторов трансферрина с трансферрином. Ген HFE экспрессируется в энтероцитах крипт дуоденома, где он располагается преимущественно интрацеллюларно и ассоциирован с рецепторами трансферрина TfR. Этот комплекс отвечает за регуляцию интенсивности усвоения железа в кишечнике.
Мутация гена HFE приводит к нарушению трансферрин-опосредованного захвата железа энтероцитами в дуоденальной области, что является причиной формирования ложного сигнала о дефиците железа в организме. В результате повышается секреция железосвязывающего протеина DMT-1 в ворсинках энтероцитов и, соответственно, повышенному захвату железа (при этом возникает риск развития гемохроматоза).
Исследования показали, что перенос Fe и других 2-валентных ионов металлов посредством DMT-1 является pH-зависимым. Но точный механизм регулирующего действия pH неизвестен.
Второй путь транспорта железа в кишечнике касается только Fe3+ и происходит при участии ключевого протеина мобилферрина (mobilferrin). При дефиците железа DMT-1 и мобилферрин сосредотачиваются на апикальной поверхности микроворсинок. В энтероцитах железо связывается и хранится в виде ферритина, который может либо дальше усваиваться организмом, либо экскретироваться путем слущивания эпителиальных клеток. Квота железа, необходимая для метаболизма в тканях организма, передается через базолатеральную мембрану энтероцита.
Ключевую роль в контроле уровня железа в крови выполняют два белка – гепцидин и ферропортин – путем взаимодействия, которое называют «ось гепцидин-ферропортин». Ось гепцидин-ферропортин – ключевой механизм регуляции метаболизма железа. Соотношение этих протеинов регулирует процесс выделения железа из клетки и его депонирование. Единственная известная на сегодняшний день молекулярная мишень влияния гепцидина – белок ферропортин, выполняющего функцию трансмембранного канала, посредством которого происходит транспорт Fe из крови в клетку. При повышении концентрации железа в крови повышается уровень гепцидина, что ингибирует процесс усвоения железа в кишечнике и высвобождение резервного железа.
В организме человека за транспорт и депонирование железа отвечает группа протеинов – сидерофилины, к которым относятся негемовые гликопротеины: трансферрин плазмы крови и лактоферрин молока и многих других секретов, в которых он представлен протеиновым компонентом гранул полиморфно-ядерных лейкоцитов). Сидерофилины объединяет наличие двух участков связывания 3-валентного железа.
К энтероцитам подходит p-глобулин (трансферрин). В норме содержание трансферрина в крови – 250 мг/дл. Каждая молекула трансферрина способна переносить 1-2 иона железа; то есть, в нормальном состоянии трансферрин способен связывать примерно 250-400 мг железа на 100 мл плазмы крови. Способность трансферрина связывать железо называют «общая железосвязывающая способность сыворотки крови». Так железо попадает в кровь (сывороточное железо), потом в органы депонирования (печень, селезенку). Затем железо в виде апотрансферрина может возвращаться обратно в кровь (апотрансферрин – 1-цепочный протеин, состоящий из 700 аминокислот, способный связывать железо). В нормальном состоянии уровень насыщения трансферрина железом составляет примерно 25-40% - 1/3 от общей железосвязывающей способности.
В организме человека содержится примерно 3-5 г железа, которое распределено следующим образом:
- 65% всего железа организма содержится в гемоглобине (хромопротеид)
- примерно 25% (от 15 до 30%) – депонированные формы железа (гемосидерин, ферритин)
- 3,5% - миоглобин
- 0,5% – тканевые ферменты
- 0,1% - сывороточное железо
Ферритин – лабильный пул железа – растворимая нетоксичная форма в протеиновой оболочке (апоферритин), присутствующая в цитозоле практически всех клеток организма; период полураспада – примерно 60 часов. Ферритин является легкодоступным резервом для синтеза железосодержащих соединений. Основная часть ферритина находится в костном мозге и ретикулоцитах. Одна молекула ферритина может связывать до 4500 атомов 3-валентного железа. Также он является белком острой фазы воспаления – его уровень повышается при неопластических и инфекционных процессах, во время беременности. Концентрация 1 мкг/л ферритина в крови соответствует 10 мкг депонированного железа (отметим, что этот показатель не информативен при лечении, так как терапия препаратами железа в течение 3 недель или парентеральное введение декстрана железа в течение нескольких дней приводит к повышению концентрации ферритина в крови до нормальной и высокой).
В печени и селезенке (в лизосомах в основном макрофагов) железо вступает в связь с нерастворимыми субстратами, образуя гемосидерин (деградированный ферритин) – нерастворимая форма депонированного железа, которая является конечным продуктом метаболизма железа (без протеиновой оболочки).
Лактоферрин, который высвобождается при дегрануляции полиморфно-ядерных лейкоцитов, поглощается макрофагами после связывания с железом, находящемся в участках инфицирования. Также лактоферрин способен связывать избыточное железо в кишечнике. Грудное молоко содержит ненасыщенный лактоферрин, таким образом обеспечивая ингибирование развития железозависимых микроорганизмов (бактероиды, сальмонеллы, клостридии, микобактерии, эшерихии, стафилококки).
Из организма человека железо выводится с калом, мочой, потом, путем слущивания эпителиальных клеток кишечника, отрастания ногтей и волос. Общая потеря железа организмом не зависит от пола и составляет примерно 1 мг/сут (у женщин в период менструации – 2-3 мг/сут).
ПРОДОЛЖЕНИЕ ЗДЕСЬ: Эритропоэз: Гемоглобин и Эритроциты. Часть 4
Массу эритроцитов, которая циркулирует в крови, можно сравнить с большим специализированным...
Организм человека содержит примерно 4 г железа. В норме 1-2 мг железа в сутки усваивается из...
Анемия не является заболеванием – это патологический симптом, возникающий по ряду...
Щитовидная железа локализуется в области шеи, имеет форму бабочки. Железа разделена на две...
Ferrum phos. является одной из Шусслеровых тканевых солей. Порошкообразный фосфат железа...
анализы, БАД, биологическая медицина, витамины, гастроэнтерология, гигиена, гинекология, гомеопатия, дерматология, диагностика, диетология, заболевания, иммунология, инфекционные заболевания, инфекция, исследования, кардиология, кожа, косметика, красота, лекарственные растения, лечение, лицо, неврология, обследование, оздоровление, онкология, ортопедия, педиатрия, питание, пищеварительная система, поведение, похудение, препараты, продукты, профилактика, процедура, психология, пульмонология, рак, реабилитация, сердечно-сосудистая система, ССС, тело, терапия, травматология, уход, фитотерапия, хирургия, эндокринология
Показать все теги

Комменатрии к новости