Ранняя диагностика колоректального рака
Согласно данным эпидемиологических исследований, в последние десятилетия в мире отмечается...
Медицина / Физиология / Физиология (статья)
 Тестостерон и рак предстательной железыПоследние исследования показали неоднозначную взаимосвязь между раком предстательной железы и тестостероном. На сегодняшний день известно, что причиной «голодной опухоли предстательной железы» является не тестостерон, а его дефицит. Большинство врачей испытывают информационно-методологический кризис, который вызван накоплением огромного количества научных данных, которые опровергают незыблемые догмы и постулаты урологии и онкологии о роли тестостерона в патогенезе рака предстательной железы. Данная ситуация требует радикальных изменений в представлении врачей о механизмах рака предстательной железы и как, когда и чем его лечить?
Тестостерон и рак предстательной железыПоследние исследования показали неоднозначную взаимосвязь между раком предстательной железы и тестостероном. На сегодняшний день известно, что причиной «голодной опухоли предстательной железы» является не тестостерон, а его дефицит. Большинство врачей испытывают информационно-методологический кризис, который вызван накоплением огромного количества научных данных, которые опровергают незыблемые догмы и постулаты урологии и онкологии о роли тестостерона в патогенезе рака предстательной железы. Данная ситуация требует радикальных изменений в представлении врачей о механизмах рака предстательной железы и как, когда и чем его лечить?
В истории открытия и нашего понимания физиологической роли тестостерона как основного мужского полового гормона можно условно выделить несколько периодов.
Эмпирический охватывает практически всю историю человечества, которое с момента своего зарождения искало «элексир молодости», вплоть до открытия и синтеза тестостерона в 1930-х годах. В 1849 г. Bertold, впервые показав, что последствия кастрации у петуха исчезают после реимплантации ему яичек, заложил основы научной эндокринологии. В 1889 г. свои сенсационные опыты с экстрактом семенников быка провел всемирно известный профессор Броун-Секар. В 1905 г. E. Starling ввел в науку термин «гормон». В 1911 г. Pezard представил первые объективные доказательства существования биологически активных веществ - так называемого реювенильного фактора - в экстрактах свиных яичек (Н. Burrows, 1949). Два десятилетия спустя Butenandt очистил первый андроген — андростерон из матки женщины, а в 1935 г. Дэвид и соавт. изолировали более активный, чем андростерон, андрогенный компонент из свежей ткани яичек, который они и назвали тестостероном (Н. Burrows, 1949).
Революционным прорывом в мировой науке стало установление структуры и осуществление синтеза тестостерона Дэвидом, Лакуером и Ружичкой в 1935 г.
С 1937 г. началось первое клиническое использование тестостерона пропионата в качестве депо-препарата, а в 1968 г. Бруховски и Вил сон обнаружили периферическое превращение тестостерона в 5-α-дигидротестостерон, для которого в этом же году Андерсон и Лэй описали специфические рецепторы в простате. Первые исследования, показавшие положительное влияние тестостерона на состояние сердечно-сосудистой системы у мужчин и впоследствии доказанные в исследованиях других авторов, были проведены в СССР С.И. Карчикяном (1930 г.) и Т.Т. Глухеньким (1946 г.). Перед тестостероном открылось весьма перспективное будущее. Однако с 1940-х годов и по сей день тестостерон является заложником научных мифов и камнем преткновения для урологов, онкологов и эндокринологов благодаря работам С. Huggins и соавт. (1941 г.), которые у одного пациента из трех больных раком предстательной железы (РПЖ) на фоне введения препаратов тестостерона обнаружили повышение уровня кислой фосфатазы крови - суррогатного маркера РПЖ. На основании данного исследования был сделан вывод о том, что «...тестостерон - пища для голодной опухоли», который стал тормозом развития учения о тестостероне. При этом С. Huggins в 1966 г. был удостоен Нобелевской премии в области медицины за установление механизмов развития и прогрессирования рака простаты.
«Враг правды, чаще всего, не ложь... а миф», - сказал однажды Д Кеннеди (1966 г.). В среду таких мифов сразу попал и тестостерон, при одном упоминании которого урологи в ужасе отмахиваются руками, а онкологи готовы оторвать голову каждому, кто хоть случайно поставит рядом слова «рак предстательной железы» и «тестостерон». «...Тестостерон - пища для голодной опухоли», - однако сегодня хорошо известно, что как аденома, так и рак простаты возникают на фоне возрастного дефицита тестостерона, т.е. в отсутствие «пищи для опухоли», а когда «пищи» много, т.е. тестостерона, - в 20-30 лет ни аденомы, ни РПЖ нет! Возникает закономерный вопрос: если тестостерон так плох для простаты, то почему сегодня никто не может это положение однозначно доказать? Мифу о том, что тестостерон сам по себе вызывает развитие и прогрессирование рака простаты, исполнилось уже 70 лет.
«65-летний миф должен быть развеян, если мы хотим продвинуться дальше в лечении мужчины, в том числе и лечении рака предстательной железы», - так писал в 2006 г. выдающийся оперирующий онкоуролог современности A. Morgentaler, который сегодня имеет самый большой в мире опыт лечения тестостероном мужчин не только после терапии или хирургического лечения рака простаты, но и на фоне нелеченого рака простаты. Результаты его работ опубликованы и доступны всем желающим на соответствующих англоязычных медицинских сайтах.
Сегодня в связи с накоплением новых научных данных медики переживают период переосмысления роли тестостерона в патогенезе заболеваний у мужчин, в том числе и рака предстательной железы. Патофизиологическая взаимосвязь «тестостерон - рак простаты» представляется сложной, но не такой однозначно негативной, как ранее.
Так, в своей работе J. Massengil и соавт. (2003 г.) показали, что при снижении тестостерона возрастает вероятность экстракапсулярной инвазии опухоли.
Частота положительных биопсийных находок рака простаты выше среди мужчин с более низким уровнем тестостерона, чем у мужчин с нормальным уровнем, что, скорее всего, обусловлено повышенной экспрессией протоонкогена c-Met в мембранах простатических клеток.
На сегодняшний день проведен мощный метаанализ 12 исследований (3886 мужчин с РПЖ и 6438 группы контроля), который показал, что нет ассоциации между риском рака простаты и уровнем в крови разных форм тестостерона или эстрогенов.
В 2003 г. A. Morgentaler и соавт. опубликовали работу «Лечение тестостероном гипогонадных мужчин с простатической интраэпителиальной неоплазией высокой степени». Они показали, что рак простаты развивается у 25,8% пациентов с простатической интраэпителиальной неоплазией (ПИН) высокой градации на протяжении трех лет. В исследование было включено 75 мужчин, средний возраст 59,6 года, всем выполнялась биопсия простаты до терапии. Всех лечили тестостероном на протяжении одного года. Не диагностировано изменения простатоспецифического антигена (ПСА) ни в одном случае. Рак предстательной железы был диагностирован лишь у одного больного с ПИН высокой степени. Сделано заключение, что терапия тестостероном безопасна даже у больных высокой группы риска. В целом частота выявления рака простаты при лечении тестостероном не превышает 1%, что вполне сопоставимо с его выявлением в общей популяции мужчин.
Недавно опубликована новая сенсационная с точки зрения современных взглядов на патогенез и лечение рака простаты работа A. Morgentaler и соавт. (2011 г.) «Терапия тестостероном мужчин с нелеченым раком предстательной железы», в которой на 13 симптоматических больных с андрогенным дефицитом и нелеченым раком простаты показана безопасность андрогенотерапии в течение 2,5 лет. Средний возраст мужчин был 58,8 года. По шкале Глиссона у 12 больных имелось 6 баллов, у одного больного - 7. Значимого увеличения уровня ПСА крови в ходе лечения не выявлено. Объем простаты также не изменился. При этом в 54% повторных прицельных биопсий предстательной железы клетки рака не выявлялись.
У большинства специалистов нет опыта лечения пациентов с установленным РПЖ андрогенами, поскольку на сегодняшний день данное заболевание - противопоказание для андрогенотерапии. Однако у одной из групп специалистов есть более чем 5-летний опыт наблюдения пациентов с раком предстательной железы в анамнезе, получающих андрогенотерапию: 10 пациентов после радикальной простатэктомии и 5 после брахитерапии. У всех пациентов на фоне андрогенотерапии отсутствует повышение ПСА Более того, именно комбинированная терапия с включением андрогенов у всех пациентов позволила ликвидировать эректильную дисфункцию, возникшую как осложнение операции или брахитерапии (у ряда пациентов половая функция нормализована только андрогенами, другие получают ингибиторы фосфодиэстеразы 5-го типа, 2 пациента - MUSE - внутриуретральные инстилляции простагландина Е). Назначение андрогенов привело также к нормализации липидного и углеводного обменов у наших пациентов.
Мы считаем, что только это обстоятельство позволило достичь у большинства из них удовлетворительного и хорошего качества жизни, что является сегодня целью терапии любого заболевания.
В условиях прогрессивного роста частоты в популяции мужчин метаболического синдрома (МС) большинство современных исследований выявили достоверные положительные корреляции между компонентами МС, с одной стороны, и РПЖ - с другой. Ожирение как ключевой компонент метаболического синдрома является доказанным фактором риска развития злокачественных новообразований не менее 12 локализаций, включая рак почек и предстательной железы.
Большинство современных работ свидетельствует о негативной роли метаболического синдрома в канцерогенезе рака предстательной железы Проведенный в Финляндии мультивариационный анализ (1880 пациентов) показал, что у мужчин, имевших компоненты метаболического синдрома, риск рака поджелудочной железы был повышен вдвое. В другом моновариационном анализе показаны положительные связи между РПЖ и гипергликемией, низким уровнем липопротеинов высокой плотности (ЛПВП), повышенной окружностью талии и высоким уровнем систолического и диастолического артериального давления (АД).
R. Martin (2009 г.) показал, что каждое 12-миллиметровое увеличение диастолического АД независимо повышало риск РПЖ на 8%.
Данные Helsinki Heart Study показали, что пациенты с повышенным индексом массы тела – ИМТ >28 и систолическим АД >150 мм рт. ст. имели риск развития рака простаты в 2 раза выше, а в сочетании с низким уровнем ЛПВП <1,05 мМоль/л - в 3 раза выше, чем мужчины без этих нарушений.
В большом исследовании когорты из 950 тыс. норвежцев показано, что тучные мужчины в возрасте 50—59 лет имели риск развития рака предстательной железы на 50% выше по сравнению с худыми пациентами. Существенные положительные корреляции между ИМТ и РПЖ выявил также метаанализ из 56 исследований (68 753 больных), по результатам которого риск ракового поражения железы увеличивается на 5% при увеличении ИМТ на каждые 5 кг/м2.
Некоторые исследования свидетельствуют, что компоненты метаболического синдрома могут также приводить к более агрессивному раку предстательной железы. Так, каждое увеличение ИМТ на 5 пунктов достоверно увеличивало риск местнораспространенного РПЖ, а между уровнем триглицеридов крови и частотой рака простаты выявлена обратная корреляция.
Недавнее ретроспективное изучение показало, что у мужчин с ИМТ >35 в 2-3 раза увеличивается риск выявления более агрессивной гистологической формы РПЖ после радикальной простатэктомии (сумма по шкале Глиссона более 7, положительные результаты хирургического края, экстрапростатическая инвазия в семенные пузырьки), чем у мужчин с ИМТ <25. Частота биохимических рецидивов рака также была выше при избытке массы тела у кавказцев и афроамериканцев. J. Hammarsten и В. Hogstedt (2004, 2005 гг.) показали, что стадия и гистологический вариант рака простаты непосредственно связаны с ИМТ, уровнем триглицеридов и инсулина крови после пищевой нагрузки, а также косвенно с уровнем ЛПВП. При этом достоверно более высокие плазменные уровни инсулина были отмечены у тех, кто умер от рака простаты, по сравнению с теми, кто его пережил, а смертность от РПЖ была достоверно связана с количеством компонентов МС.
С другой стороны, есть противоположное мнение, что некоторые компоненты МС могут фактически уменьшать риск РПЖ. Так, A. Tande и соавт. (2006 г.) наблюдали за 6429 мужчинами в исследовании ARIC и пришли к выводу, что метаболический синдром с сахарным диабетом (СД) типа 2 или без него был достоверно связан с уменьшенным риском рака простаты.
J. Kasper и соавт. (2009 г.) показали в ходе мультивариационного анализа, что сахарный диабет типа 2 был связан с 17-процентным уменьшенным риском общего количества случаев рака предстательной железы, 28-процентным уменьшенным риском ограниченного РПЖ, 31-процентным уменьшенным риском РПЖ высокой градации и 24-процентным уменьшенным риском РПЖ низкой градации.
Дальнейший анализ показал, что пациенты с излишком массы тела (ИМТ >25) и сахарным диабетом типа 2 имели риск рака предстательной железы на 19% меньше, чем мужчины с излишней массой тела, но без сахарного диабета типа 2.
Мультивариационный анализ 72 670 мужчин из исследования CPSII NC показал, что после 4 лет течения СД типа 2 имелось уменьшение на 37% риска развития рака простаты. Кроме того, диабет уменьшал частоту как неагрессивного рака железы (I—II стадии, менее 8 баллов по шкале Глиссона), так и агрессивного (III и IV стадии, более 8 баллов по шкале Глиссона).
Таким образом, роль нарушений углеводного обмена в индукции и прогрессировании рака предстательной железы требует дальнейших исследований.
Состояние хронического воспаления, связанное с МС, может вносить свой вклад в увеличение риска рака простаты, так как при МС повышены уровни цитокинов (интерлейкина - ИЛ-1β, 6, фактора некроза опухоли α - ФНО-α, С-реактивного белка и ИЛ-8).
Уровни ФНО-α, ИЛ-6, 8 и 1β связаны с увеличенным риском РПЖ и его метастатической стадией. ИЛ-1β и ФНО-α показали способность стимулировать выработку ИЛ-8 в андрогензависимом и андрогеннезависимом цикле культуры клеток рака простаты, которые in vivo показали способность поглощать ФНО-α. Показана способность ФНО-α уменьшать экспрессию андрогеновых рецепторов и чувствительность к 5-α- дигидротестостерону в LNCAP-клетках, что может вносить вклад в развитие андрогеннечувствительности в клетках рака простаты. Кроме того, описанные цитокины способны стимулировать ядерный фактор κВ (NF-κВ), и это, вероятно, может играть роль связующего пути метаболизма между высокими уровнями цитокинов и РПЖ. Обратные корреляции между активностью NF-κВ и чувствительностью андрогеновых рецепторов в моделях рака предполагают для NF-κВ роль в андрогеннезависимой прогрессии рака предстательной железы.
Мы разделяем точку зрения большинства современных исследователей и клиницистов, что андрогенный дефицит является фактором риска развития и прогрессирования как метаболического синдрома, так и рака предстательной железы.
Кроме того, андрогенный дефицит у мужчин сегодня должен рассматриваться как новый патогенетически важный компонент метаболического синдрома.
Об этом свидетельствуют результаты наиболее крупного на сегодняшний день двойного слепого плацебо-контролируемого исследования роли коррекции гипогонадизма в лечении мужчин с метаболическим синдромом (С.Ю. Калинченко и соавт., Moscow study, 2008), проведенного на 184 больных. В ходе исследования достоверно доказано, что у мужчин с МС и гипогонадизмом необходима коррекция гипогонадизма препаратами тестостерона, поскольку такая терапия оказывает положительный эффект в отношении всех компонентов МС (масса тела, окружность талии, уровень в крови глюкозы, инсулина, ЛПВП, липопротеинов низкой плотности, триглицеридов). Определение уровня общего тестостерона рекомендуется производить всем мужчинам с метаболическим синдромом.
В исследовании Moscow study пациенты длительно получали андрогены, но существенного повышения уровня общего ПСА и увеличения объема предстательной железы не наблюдалось.
Известно, что низкий уровень тестостерона в крови нарушает гормональный баланс в простате, который ведет к пролиферации железистого эпителия за счет активации 5-α-редуктазного механизма, роль которого в патогенезе рака предстательной железы активно обсуждается. Существует критический ангионеогенез для выживания опухоли, при исследовании которого выяснилось, что андрогены регулируют уровень сосудистого эндотелиального фактора роста (VEG-F) в моделях РПЖ. G. Schatzl и соавт. (2003 г.) показали, что плотность микрососудистого русла обратно пропорционально связана с уровнем тестостерона сыворотки у мужчин с недавно диагностированным раком предстательной железы.
Повышенная 5-α-редуктазная активность была выявлена у пациентов с сахарным диабетом типа 2 и ожирением, которая посредством усиления простатической стимуляции может индуцировать развитие рака простаты.
Активация 5-α-редуктазного механизма может идти двумя путями:
- негеномным (традиционным андрогензависимым);
- геномным (андрогеннезависимым - вследствие мутаций андрогеновых рецепторов).
Высокая частота выявления мутаций андрогеновых рецепторов в биопсийных материалах РПЖ позволяет высказаться, что одной только 5-α-редуктазной активности недостаточно для запуска любого пути развития РПЖ. В современной литературе есть данные, что мужчины с коротким типом андрогенового рецептора (небольшое число CAG-повторов на N-терминал и рецептора) более предрасположены к раку простаты, чем мужчины с нормальным или длинным его вариантом. Поэтому управление над РПЖ возможно с помощью выявления полиморфизма гена андрогеновых рецепторов, что позволит прогнозировать риск РПЖ в любом возрасте. Другой перспективный путь борьбы с раком предстательной железы, по мнению некоторых специалистов, может лежать на пути создания таргетных препаратов для модуляции эффектов андрогеновых рецепторов.
Низкий уровень тестостерона, который часто наблюдается при МС, патогенетически связан с более агрессивным РПЖ. В ретроспективном анализе мужчины с низким уровнем тестостерона плазмы (<3 нг/мл) имели более высокий риск РПЖ высокой градации по Глиссону. Низкий уровень тестостерона был достоверно связан с более высоким ПСА и положительными краями при радикальной позадилонной простатэктомий. Низкий уровень тестостерона крови патогенетически связан с гиперинсулинемией / инсулинорезистентностью как через объем мышечной ткани, так и специфические трансмиттеры, среди которых наиболее изучен инсулиноподобный фактор роста 1 (ИФР-1). Как известно, инсулин имеет выраженный промитогенный и антиапоптотический эффекты, и повышенный уровень инсулина стимулирует рост предстательной железы.
Увеличивающееся число компонентов МС обратно пропорционально уровню ИФР-1 в сыворотке крови, также как и отношению ИФР-1 / белок ИФР-3, а последний является маркером биодоступности ИФР-1.
Окружность талии, систолическое АД и уровень триглицеридов крови обратно пропорционально коррелируют с отношением ИФР-1 / белок ИФР-3, а также с уровнем ЛПВП крови. Уровень ИФР-1 обратно пропорционально коррелирует с риском развития СД типа 2, уровнями гликированного гемоглобина HbА1с и С-реактивного белка, а также с артериальной гипертонией. Есть также данные о существенных прямых отношениях между уровнями ИФР-1 и увеличением общего количества рисков как низко-, так и высокодифференцированного рака предстательной железы. На эксперименте ИФР-1 показал свою способность приводить к быстрому увеличению клеток простаты и блокированию их апоптоза. Таким образом, между компонентами метаболического синдрома и андрогенным дефицитом, с одной стороны, и раком предстательной железы - с другой, существуют тесные патофизиологические связи, уточненные в последние годы (см. рисунок).
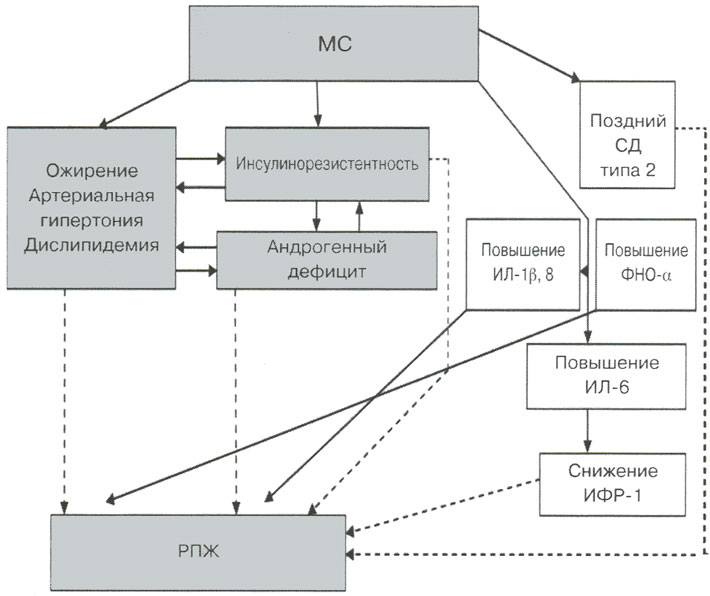
Механизмы системного гормонально-метаболического канцерогенеза при раке предстательной железы
Несмотря на огромное количество современных работ, показывающих безопасность тестостерона для предстательной железы и негативное влияние его дефицита на метаболизм железы, рак простаты является сегодня противопоказанием к назначению препаратов тестостерона мужчинам. Традиционно перед назначением препаратов тестостерона уролог обязан провести определение уровня общего ПСА в крови и выполнить пальцевое ректальное исследование простаты. При нахождении ПСА в пределах до 4 нг/мл и нормальных характеристиках предстательной железы не существует сдерживающих противопоказаний к терапии андрогенами.
Но как бы там ни было, «...клиницисты сегодня уже проводят андрогенотерапию при нелеченом и еще не диагностированном раке простаты, поскольку результаты биопсии выявляют рак простаты у 15% больных с ПСА <4 нг/мл и менее» (А. Morgentaler и соавт., 2011).
Это связано с определенным методологическим кризисом диагностической и прогностической роли ПСА как маркера РПЖ, который мы сегодня переживаем.
Проведенные к настоящему времени исследования продемонстрировали неоднозначные взаимоотношения между тестостероном и РПЖ. Но сегодня уже ясно, что не тестостерон является «пищей для голодной опухоли предстательной железы», а его дефицит. Мы испытываем определенный информационно-методологический кризис, связанный с накоплением критического объема научных данных, которые, по сути, опровергают до этого незыблемые догмы и постулаты урологии и онкологии о роли тестостерона в патогенезе РПЖ, что требует революционных изменений наших представлений о механизмах его развития и, самое главное, решения кардинальных вопросов: как, когда и чем лечить? По нашему мнению, патогенетическое решение проблемы управления РПЖ может быть достигнуто только при определенных условиях, среди которых можно выделить:
- дальнейшее продолжение исследований по раку поджелудочной железы только в рамках междисциплинарного подхода;
- пересмотр роли ПСА как маркера РПЖ (ПСА - простатоспецифический, а не раковоспецифический антиген);
- оптимизацию диагностической и прогностической роли ПСА путем установления его референтов в группах больных в зависимости от особенностей их гормонально-метаболического статуса, или эра ПСА закончится;
- поиск новых метаболических маркеров рака предстательной железы которые бы учитывали влияние на их референтные уровни системных факторов патогенеза рака предстательной железы, уже известных современной науке (метаболический синдром, ожирение, инсулинорезистентностъ, сахарный диабет типа 2, андрогенный дефицит и т.д.);
- изучение особенностей морфологии опухолей предстательной железы с учетом особенностей гормонально-метаболического статуса пациентов;
- усовершенствование гистохимических методов диагностики рака предстательной железы.
Как писал В.М. Дильман (1983 г.), «...одним из эффективных средств профилактики рака может быть поддержание гормонов в организме человека на уровне 20-25-летнего возраста...». Поэтому прогресс в области ранней диагностики и терапии рака предстательной железы лежит в преодолении мифов и страхов перед андрогенами, а сделать это возможно только в аспекте междисциплинарного подхода к данной проблеме, требующей в силу своей высокой медико-социальной значимости несомненного продолжения дальнейших углубленных исследований.
Согласно данным эпидемиологических исследований, в последние десятилетия в мире отмечается...
В мире от рака молочной железы погибают примерно 600000 женщин в год. в Европе ежегодно 180000...
Британские ученные назвали основной признак развития рака. Это заявление было сделано...
Злокачественные новообразования – это группа заболеваний, которых насчитывается более...
Проблема гиперандрогении у женщин имеет несколько уровней реализации. Нарушение регуляции в...
анализы, БАД, биологическая медицина, витамины, гастроэнтерология, гигиена, гинекология, гомеопатия, дерматология, диагностика, диетология, заболевания, иммунология, инфекционные заболевания, инфекция, исследования, кардиология, кожа, косметика, красота, лекарственные растения, лечение, неврология, неонатология, обследование, оздоровление, онкология, ортопедия, педиатрия, питание, пищеварительная система, поведение, похудение, препараты, продукты, профилактика, процедура, психология, пульмонология, рак, реабилитация, сердечно-сосудистая система, ССС, тело, терапия, травматология, уход, фитотерапия, хирургия, эндокринология
Показать все теги

Комменатрии к новости