Скрининг при вакцинации против ВПЧ
С началом выполнения скрининговых программ для выявления рака шейки матки (РШМ) заболеваемость...
Медицина / Диагностика / Диагностика (статья)
 ЛабораторияКак вы представляете себе деятельность, связанную с контролем качества лабораторных исследований? Воспринимаете ли вы эту деятельность как имеющую особое значение в повседневной жизни вашей лаборатории? Или вы считаете это дополнительной, часто обременительной работой, которую необходимо выполнять только потому, что этого требуют регуляторные и аккредитационные организации?
ЛабораторияКак вы представляете себе деятельность, связанную с контролем качества лабораторных исследований? Воспринимаете ли вы эту деятельность как имеющую особое значение в повседневной жизни вашей лаборатории? Или вы считаете это дополнительной, часто обременительной работой, которую необходимо выполнять только потому, что этого требуют регуляторные и аккредитационные организации?
Всеобъемлющее управление качеством — это путешествие, а не пункт назначения
Thomas Berry
К сожалению, последнее заблуждение все еще широко распространено до сих пор, несмотря на то, что более 18 лет назад Американский колледж патологов впервые представил программу Q-PROBES, направленную на сбор данных относительно производительности национальных лабораторий по некоторым показателям качества выполняемой работы. Создается впечатление, что значительная часть медицинского лабораторного сообщества до сих пор не понимает, что качество должно быть «встроено» в рабочий процесс, а не контролируемо извне, для обеспечения качества и безопасности пациентов. Многие лаборатории упускают это из виду, сосредотачивая внимание на конечном пункте (то есть прохождении инспекции по аккредитации), вместо того чтобы более тщательно составить маршрут и пользоваться благами своего путешествия.
Как любое путешествие начинается с первого шага, так и путь к полному контролю качества должен начинаться с понимания взаимоотношений между качеством медицинской лабораторной деятельности, которая должна быть разработана и поддерживаема лабораторным менеджментом и технологической деятельностью, обеспечивающей результаты лаборатории в отношении лечения пациента. К счастью, данная двойственная связь очень проста, может быть описана графически и стать фундаментальной базой для контроля и улучшения качества в любой медицинской лаборатории независимо от размера, масштаба или специализации где бы то ни было в мире.
Потребовалось время для того, чтобы двойственные административные связи между мероприятиями по контролю качества медицинской лаборатории и технологической деятельностью стали всесторонне картографированы. Все началось в 1992 г. в США, когда FDA (Food and Drug Administration – Управление по контролю за качеством пищевых продуктов и лекарственных средств, США) собрала общественный семинар, чтобы решить систематические проблемы качества, касающиеся зараженной вирусом ВИЧ-СПИД «национальной кровеносной сети». Обеспокоенность FDA подстегнула лаборатории банков крови первыми обратить внимание на двойственные взаимоотношения как по активности, связанной с управлением качеством, так и по технологической процедурной деятельности.
На семинаре FDA окончательно были выработаны практические рекомендации по обеспечению качества (донорской крови), разработано дополнение к требованиям FDA по надлежащей производственной практике. Американская ассоциация банков крови отреагировала на практические рекомендации FDA публикацией «Программы качества». В этой Программе впервые были графически концептуализированы взаимоотношения между мероприятиями по управлению качеством, санкционированными FDA, согласно требованиям надлежащей производственной практики и технологическим процедурам банка крови.
Персонал лаборатории, работающий в пунктах переливания крови на базе лечебных учреждений, вскоре осознал, что взаимосвязь между управлением качеством и технологической деятельностью распространилась далеко за пределы службы переливания крови — на все другие специальные дисциплины в лабораториях клинической и анатомической патологии. В 1999 г. подкомитет NCCLS (National Committee for Clinical Laboratory Standards – Национальный комитет по клиническим и лабораторным стандартам, США) выражающий лабораторные, промышленные и правительственные точки зрения, выпустил первую медицинскую специально разработанную для лабораторий модель системы управления качеством (quality management system — QMS). За основу этой примечательной модели были взяты нормативные документы, требования к аккредитации и лабораторные стандарты, которые существовали в то время. В 2004 г. CLSI (Clinical and Laboratory Standards Institute – Институт клинических и лабораторных стандартов (до 2005 года – Национальный комитет по клиническим и лабораторным стандартам), получивший статус всемирной некоммерческой организации по разработке сандартов и рекомендаций в сфере медицины) опубликовал последние обновления к своей модели QMS, выход новой редакции которых был запланирован на 2008 г.
Одновременно с обобщением CLSI мероприятий по контролю качества лабораторных исследований в конце 1990-х группа международных представителей из организаций по аккредитации лабораторий, научных кругов, общественных и частных лабораторий также начала преобразовывать уже распространенный международный стандарт для работы немедицинских промышленных лабораторий и для применения в условиях медицинских лабораторий. Первым результатом было создание международного медицинского лабораторного стандарта ISO 15189: «Лаборатории медицинские. Частные требования к качеству и компетентности». Этот международный стандарт, впервые опубликованный в 2003 г., требует от медицинских лабораторий всего мира выполнять положения QMS, что обеспечит уровень лабораторных исследований и выполнение того, что признано необходимым для обеспечения минимально приемлемого уровня лечения и безопасности пациента. Положения стандарта детально регулируют как элементы управления качеством, так и лабораторную технологическую деятельность, необходимые для достижения указанной общей цели. В нескольких странах данный документ приняли как национальный стандарт и разработали программы по лабораторной аккредитации, основываясь на требованиях указанного выше стандарта (одним из примеров является Канада).
В США к лабораториям выдвигается так много национальных, государственных и частных требований, что отслеживать их соблюдение каждой отдельной организацией становится крайне сложно и отнимает много времени. К счастью, модель CLSI QMS дает возможность группировки всех схожих требований различных управляющих, аккредитационных и устанавливающих стандарты организаций в легкодоступную форму. Данная полезная основа дает возможность лабораториям улучшать качество и технологические принципы, процессы и процедуры, которые соответствуют всем современным нормативным требованиям. В свою очередь, эти документы описывают лабораторную QMS. Понимание данной модульной структуры и использование ее в целях осуществления деятельности, необходимой для удовлетворения требований, — это самое лучшее и легкое для лаборатории средство по «внедрению качества» в свою повседневную работу в интересах излечения и безопасности пациента.
Далее в статье обсуждаются отдельные элементы модели QMS и то, как лаборатории могут использовать ее для создания такой QMS, которая даст возможность охватить все регулирующие и аккредитационные требования, подготовить лаборатории к внеплановым проверкам и тем самым внести свой весомый вклад в лечение и безопасность пациента.
Работа в медицинской лаборатории состоит из технологических процедур, производящих лабораторные результаты по лечению пациента, а также из управленческой деятельности по обеспечению технологической работы. В обязанности технического персонала лаборатории входит осуществление таких видов деятельности: преаналитической (сбор образцов крови, получение и внесение в базу данных); аналитической (тестирование, исследование, интерпретация); постаналитической (отчетность по результатам, архивирование образцов, регистрация подлежащих оплате услуг), которые преобразуют предписания клинициста по лабораторному тестированию или исследованию в результаты, используемые врачом для диагностики и лечения пациентов.
Более того, должностной обязанностью администрации и управленческого персонала лаборатории является разработка и внедрение вспомогательной инфраструктуры, которая необходима для беспрепятственного осуществления технологической работы. Всесторонняя координация технологической и управленческой деятельности имеет важное значение для осуществления постоянной, бесперебойной, высококачественной, безошибочной, квалифицированной и эффективной работы лаборатории. Важная взаимосвязь между технологическим и управленческим видами деятельности проиллюстрирована на рис. 1. Важно отметить, что на данном рисунке также отображена модель QMS, которая может быть использована в условиях медицинской лаборатории.
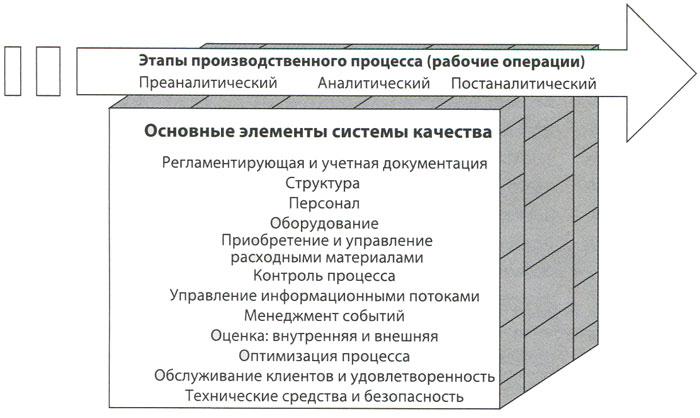
Рис. 1. Простая базовая модель системы контроля качества (Из CLSI. Утвержденное CLSI руководство HS1: модель системы качества для здравоохранения. Второе издание. Wayne (PA): 2004. P. 4)
Основные элементы системы качества (quality system essentials — QSE), впервые представленные Американской ассоциацией банков крови и адаптированные позднее NCCLS-CLSI, являются фундаментальными и обобщенными элементами управленческой инфраструктуры, которые обеспечивают выполнение технологической работы лаборатории. Каждый QSE состоит из совокупности важнейшей информации, характеризующей основы управленческой деятельности. Для успешного выполнения технологической работы каждый QSE должен функционировать должным образом.
Информация по каждому из 12 пунктов QSE собрана непосредственно из регулирующих, аккредитационных и единых требований для лабораторий и банков крови. Структура каждой QSE была впервые подготовлена к упорядочению в соответствии со всеми текущими на то время (приблизительно 1997 г.) требованиями согласно темам QSE. Каждый пункт соответствовал наиболее подходящему QSE:
Данная компиляция была опубликована и впоследствии послужила базой для исходного руководства NCCLS- CLSI.
CLSI регулярно обновляет QSE, добавляя каждое вновь опубликованное руководящее, аккредитационное или социальное требование к соответствующим QSE. Расширяя базу источников, CLSI внес в новое издание QSE пункты, которые не были представлены в требованиях, используемых в США, но были опубликованы в качестве требований в международном стандарте медицинской лаборатории ISO 15189:2003. Аккредитационные организации постепенно добавляют пункты из международного стандарта в свои требования.
В HS1-A2 руководстве CLSI представлена информация, которую составляют требования, извлеченные из каждого из 12 QSE, а также дополнительная информация об использовании QMS. Руководство GP26-A3 CLSI представляет собой информационный документ, состоящий из требований для преаналитической, аналитической и постаналитической деятельности технологического процесса медицинской лаборатории. Лаборатории могут использовать оба документа для верификации полноты, выполнения и фиксирования требований управленческой и технологической деятельности.
Данные два документа CLSI по QMS лаборатории сами по себе не являются стандартами — это руководства, извлеченные из опубликованных требований. Такое разграничение очень важно: модель QMS CLSI не устанавливает иных дополнительных регулирующих лабораторных требований, чем те, которым лаборатории США уже подчинены. Модель всегонавсего распределяет установленные требования в единые специфические тематические разделы, с помощью которых лаборатория может в дальнейшем разрабатывать свои правила, процессы и процедуры. Следовательно, модель представляет упрощенные методы понимания и реализации QMS, которые соответствуют всем регулирующим и аккредитационным требованиям.
Еще одним преимуществом модели QMS является то, что она согласовывается с любым требованием или стандартом, которые когда-либо были написаны или появятся. Указанная модель QMS постоянно обновляется и совершенствуется. Лаборатория только добавляет каждое новое требование к соответствующим QSE, а затем проверяет существующие там правила, процессы и процедуры на предмет соответствия любым дополнениям или изменениям для выполнения нового требования.
Большинство лабораторий уже выполняют требования по управлению, включая компоненты QMS. Тем не менее без стандартизированной «по месту» QMS не все необходимые мероприятия по управлению выполняются на практике в каждой лаборатории, а те, которые могут быть выполнены, не выполняются регулярно внутри одной лаборатории. В итоге нестабильность в практике управления приводит к нерациональному использованию ресурсов и неэффективности в отношении соответствия аккредитационным и нормативным требованиям. Модель QMS является унифицированным, систематизированным методом для любой лаборатории, который обеспечивает выполнение требований всегда, в каждом отделе лаборатории и каждый день.
Далее мы будем обсуждать QSE с точки зрения перспективы как создания новой лаборатории, которая не существовала ранее, так и управления уже существующей лабораторией, которая планирует предложить новую услугу. Для наглядности мы описываем добавление новой услуги по исследованию в существующей клинической лаборатории. Тем не менее, просим обратить внимание на то, что данный подход не исключает реорганизации текущей деятельности в QMS в любой лаборатории.
Перед тем как представить новое исследование, менеджмент лаборатории должен внедрить ряд крайне важных инфраструктурных элементов в логической последовательности и убедиться, что они надежно работают:
Только после того как все эти элементы окончательно готовы к работе и функционируют, можно, наконец, начинать испытание нового сервиса.
Один из способов отобразить эту важную последовательность управленческих мероприятий — несколько модифицировать модель QMS (см. рис. 1). Эта модификация показана на рис. 2, который изображает QSE, разделенную на 3 группы: 1) лаборатория; 2) производственный процесс; 3) оценка. Эти три группы последовательно заключают всю лабораторию как динамичную, цельную организацию.
 Распределение QSE модели QMS в логические группы
Распределение QSE модели QMS в логические группы
Рис. 2. Распределение QSE модели QMS в логические группы (Адаптировано из CLSI. Утвержденное CLSI руководство HS1: модель системы качества для здравоохранения. Второе издание. Wayne (PA): 2004. P. 4.)
Каждый основной компонент должен быть на своем месте в лаборатории для создания и поддержания ее полной структурной целостности.
Лаборатория может полностью ввести QMS, внедрив стандарты, процессы и процедуры для QSE, представленные на рис. 2, в соответствии с установленной последовательностью 3 групп. Этот последовательный поход также эффективен при планировании любой новой услуги лаборатории или при разделении двух или более лабораторий в пределах той же медицинской системы, либо при создании новой организации путем объединения.
Для более глубокого понимания последовательной модели QMS далее каждый элемент QSE, который представляет собой требование для лаборатории, установленное регулирующими органами, аккредитационными организациями или опубликованными стандартами, описывается отдельно.
Лаборатория должна быть юридически идентифицируемой и иметь задокументированный организационный план и структуру, которые гарантируют оказание качественных услуг пациенту и всему клиническому персоналу, ответственному за здоровье пациента и обеспечивают его безопасность. Этот план и структура должны включать:
Сфера всех лабораторных услуг должна быть четко документирована с описанием оказываемых исследовательских услуг и обслуживаемых клиентов. Все функциональные роли, обязанности и взаимоотношения подотчетности необходимо документировать и довести до каждого таким образом, чтобы сотрудники были осведомлены о занимаемых должностях в организации. Следует выполнять качественное планирование и оценку рисков в целях обеспечения соответствия текущих, измененных или новых процессов и процедур надлежащим аккредитационным и регулирующим требованиям. Распределение (то есть бюджетирование) средств, сотрудников, оборудования и материальных ресурсов необходимо для того, чтобы убедиться, что ресурсы обеспечивают адекватные возможности по удовлетворению потребностей клиентов. Требованием QMS является периодический пересмотр менеджментом лаборатории эффективности QMS в отношении удовлетворения потребностей клиента, поставленных целей и задач, а также установленных требований. Указанное выше последнее действие, анализ системы управления, должно завершиться определением приоритетов лаборатории в отношении возможностей развития, распределения ресурсов для осуществления модернизации и мониторинга деятельности по совершенствованию для обеспечения своей эффективности.
Лаборатория должна иметь достаточное рабочее пространство и оборудование, которое спроектировано, создано и модернизировано для оптимизации эффективности рабочего процесса; минимизации риска получения травм и профессиональных заболеваний; защиты сотрудников, посетителей и пациентов от общепризнанных опасностей; и соответствует требованиям государственных или производственных стандартов для оборудования и окружающей среды. Ниже перечислены несколько структурных и неструктурных элементов дизайна лаборатории, которые влияют на планирование, размещение оборудования и безопасность ее
Мероприятия по обустройству необходимы для текущего поддержания в исправном состоянии оборудования в целях сохранения функциональных, надежных и безопасных условий. Обеспечение чистоты рабочих зон и их содержание на должном уровне предполагает привлечение штата сотрудников лаборатории и вспомогательных услуг, предоставляемых крупной организацией. Лаборатория должна иметь достаточно места для хранения расходных материалов; реактивов и химических веществ; образцов проб пациентов; и материалов, полученных из образцов пациентов, таких как тканевые блоки и фиксированные препараты тканей.
Безопасность работы оборудования и проведения процедур является неотъемлемым дополнением к средствам производства. Некоторыми программами безопасности, необходимыми в лаборатории, являются:
Подготовка к соблюдению правил безопасности необходима по каждой соответствующей программе для каждого сотрудника в качестве дополнения к его или ее профессиональным обязанностям.
После того как организационная структура и обязанности каждого сотрудника определены и учтены потребности лаборатории в физическом пространстве, следующим важным ресурсом, требующим организации, является персонал. Безусловно, без квалифицированного, обученного и компетентного штата обеспечить качественное функционирование лаборатории невозможно.
Clinical Laboratory Improvement Amendment (CLIA) 1988 г. утверждает минимальные требования относительно квалификации и обязанностей персонала, выполняющего лабораторные исследования средней и высокой сложности. Наименования работ, для которых существуют эти национальные стандарты, представлены в таблице.
|
Микроскопия препаратов, приготовленных в лаборатории |
Исследования средней сложности |
Исследования высокой сложности |
|
Директор лаборатории |
Директор лаборатории |
Директор лаборатории |
|
Персонал, проводящий исследования |
Технический консультант |
Технический руководитель |
|
|
Клинический консультант |
Клинический консультант |
|
|
Персонал, проводящий исследования |
Руководитель отдела |
|
|
|
Персонал, проводящий исследования |
|
|
|
Руководитель отдела цитологии |
|
|
|
Лаборант цитологической лаборатории |
В случае необходимости лаборатории и их головные организации могут устанавливать дополнительные или более высокие квалификационные требования и уровень ответственности, если это требуется. Уровень квалификации и ответственность директора лаборатории, консультирующих патоморфологов и технических консультантов (для которых лаборатория является объектом, подлежащим оценке во время инспекций, осуществляемых без предварительного предупреждения) были опубликованы Колледжем американских патологов. Все требования к квалификации персонала и его ответственность должны быть задокументированы в должностных инструкциях, которые необходимо постоянно обновлять и которые должны быть доступны всем сотрудникам.
Лаборатория должна обеспечить официальное введение в должность всех новых сотрудников. Рекомендуемые элементы для проведения инструктажа среди сотрудников лаборатории:
Все сотрудники должны пройти подготовку в отношении рабочих процессов и процедур, которая охватывает их соответствующие рабочие задания, вне зависимости от того, имеет ли новый сотрудник предыдущий опыт работы. Необходимые подходы по обеспечению компетентности персонала оцениваются и документируются первоначально после подготовки и в дальнейшем периодически в соответствии с перечисленным ниже:
Чтобы работа и профессиональные знания сотрудников лаборатории оставались на должном уровне, лабораториям следует предоставлять программы для продолжения образования и профессионального роста. Необходима отчетность лаборатории о программах непрерывного образования. Документация, подтверждающая участие персонала во внутренних и внешних курсах повышения квалификации, должна храниться в личных делах сотрудников.
Помимо указанных выше процессов, персонал лаборатории должен также сотрудничать с отделом кадров по таким направлениям, как профессиональная иммунизация, отчетность по несчастным случаям, а также в отношении начисления и выдачи заработной платы.
После организации лаборатории, создания условий для работы и наличия персонала следует приобрести оборудование, необходимое для выполнения требуемых услуг — исследований. Методы, программы и процедуры, описанные для QSE, относятся к основному оборудованию лаборатории, инструментам и аналитическим системам, а также компьютерным системам аппаратного и программного обеспечения.
Лаборатория должна установить критерии отбора для каждой единицы оборудования, которую необходимо приобрести, и определить, какие производители соответствуют данным критериям. Перед тем как выбрать оборудование, лаборатория должна проверить, соответствуют ли материальные условия потребностям оборудования в пространстве и весовой нагрузке; электроэнергии, вентиляции, влажности и температуре; типе и качестве воды; и другим специфическим требованиям. После приобретения и перед использованием каждая единица оборудования должна быть установлена и предварительно проверена на соответствие заявленным производителем характеристикам.
После начала фактического тестирования оборудование также должно быть проверено на предмет функционирования по назначению в реальных рабочих процессах, в которых оно используется. Лабораторные графики и процедуры сопроводительные инструкции производителя необходимы для текущей профилактики, калибровки и верификации калибровки. Отчеты об эксплуатации объективно свидетельствуют о результатах этих необходимых мероприятий.
Перед началом выполнения какого-либо исследования в любой новой лаборатории либо нового процесса лаборатории следует установить и приобрести все необходимые материалы и реагенты. Лаборатории также может понадобиться приобретение таких услуг, как техническая поддержка и заключение контрактов на обслуживание и проверку лабораторных исследований. Для этих целей лаборатория должна формализовать свои потребности и нужды в документированных соглашениях с поставщиками, где будут определены обязанности каждой из сторон. Данные соглашения должны периодически пересматриваться в целях определения способности поставщиков удовлетворять потребности лаборатории, и при необходимости следует вносить коррективы.
Эффективная деятельность лаборатории требует бесперебойной доступности реагентов, расходных материалов и услуг. Лаборатории необходимо поддерживать экономически эффективный доступный запас расходных материалов и содействовать программе по закупке необходимых материалов. Критически важные реактивы и материалы должны быть приобретены, оценены и по мере потребности (перед использованием) протестированы для обеспечения выполнения необходимых требований к уровню качества.
Контроль преаналитического, аналитического и постаналитического рабочих процессов лаборатории имеет решающее значение в отношении качества результатов лабораторных исследований. Данный контроль процессов начинается с установления и документирования многих рабочих операций лаборатории. Применяется краткое руководство по лабораторным процессам с примерами. Использование надлежащим образом спроектированных технологических карт процесса эффективно определяет виды деятельности, для которых процедуры (например, инструкции) необходимы сотрудникам лаборатории в целях выполнения возложенных на них профессиональных задач. Такой анализ процесса ускоряет написание отдельных процедурных документов. Вместе процессуальные и процедурные документы — это удобная форма, которая может лечь в основу технических процедурных руководств.
Перед тем как любой процесс будет выполнен в реальных условиях, он должен быть верифицирован на предмет его соответствия намеченному результату. Верификация заключается в создании плана, который позволяет техническому персоналу подвергнуть сомнению как изначально разработанный процесс, так и документы и результаты, а также определить, соответствуют ли ранее установленные критерии процессу и может ли процесс удовлетворить потребности клиента. Методы верификации исследований также требуются в отношении процессов, в которых выполняются лабораторные исследования. К тому же лаборатория должна проверять, соответствуют ли установленные производителем спецификации процессам, оснащению, персоналу и материалам лаборатории, Для помощи в подобной верификации методов исследований лабораториям доступно несколько руководств.
Программы по контролю качества являются средствами контроля процессов исследования пациентов на уровне контрольных показателей. Лаборатории должны соответствовать установленным требованиям контроля качества методов исследований; необходимо придерживаться как минимальных требований по контролю качества, так и любого требования производителя. Использование статистических методов способно предоставить наглядные средства осмысление данных контроля качества, с тем чтобы принять своевременные меры в случае выявления проблем.
В центре лабораторной (QMS находятся принципы, процессы и регламентирующие документы, которые указывают сотрудникам, что и как делать, а учетная документация объективно свидетельствует о результатах выполняемых процессов и процедур. Аудиты выявляют тот факт, что регламентирующие документы и учетная документация лабораторий зачастую отсутствуют, неполны, устарели либо содержат некорректную информацию; все эти проблемы могут привести к ошибкам, которые могут угрожать безопасности пациентов. В настоящее время от лабораторий требуется контроль своих регламентирующих документов и учетной документации посредством перечисленных ниже процессов.
Элементы контроля документооборота:
Допустимы бумажная, электронная или обе системы контроля документооборота при условии, что только наиболее часто используемые документы доступны всему персоналу на местах выполнения их профессиональных обязанностей.
Требования, содержащиеся в данной QSE, касаются управления информацией лабораторий, содержащейся в печатных или компьютерных регистрационных системах. Эта информация включает демографические данные пациентов, результаты и интерпретацию исследований, отчеты, другие лабораторные данные, а также то, как данная информация распределена между пользователями или другими компьютерными системами. Лаборатория должна иметь принципы, выполнять процессы и проводить процедуры относительно доступа и безопасности информации, запросов о предоставлении информации, конфиденциальности информации, передачи информации (например, электронные интерфейсы и пересылка данных), а также относительно полноты данных (например, удобочитаемость и точность учетной документации).
Кроме того, необходима простая программа для управления доступом к результатам пациентов и информации в то время, когда компьютерная система не функционирует. К тому же данная QSE содержит требования к процессам по обеспечению противодействия финансовому мошенничеству и злоупотреблениям в программах по оказанию медицинской помощи населению Medicare и Medicaid.
До сих пор восемь пунктов QSE (представленные в последовательных терминах «лаборатория» и «работа») описывали действия, необходимые для подготовки лаборатории к проведению исследования и экспертизы, получаемой при этом отчетности. Остальные четыре показателя QSE смещают фокус на вопрос и ответ на него: насколько хорошо представленные в лаборатории процессы соответствуют целям и задачам качества, установленным в QSE: организации, требованиям регуляторных органов и аккредитационных организаций, а также потребностям клиентов лаборатории. Это соответствует пункту QSE «оценка».
Называемый в настоящее время «менеджментом недопустимых событий» в QSE состоит из требований к документированию и расследованию событий, которые не соответствуют установленным принципам лаборатории, процессам, процедурам либо другим предъявляемым требованиям. Программа фиксирует и анализирует информацию, касающуюся недопустимых событий и жалоб, для выявления лежащих в их основе систематических проблем и усиления обязанностей менеджмента по устранению причин. Программа менеджмента недопустимых событий содержит следующие элементы:
Этот QSE также содержит недавно установленное требование для лабораторий, заключающееся в том, чтобы с вопросами, относящимися к качеству и безопасности, сотрудники обращались к менеджменту лаборатории.
Лаборатория не может улучшить качество своих услуг без оценки своей текущей деятельности. И внешняя, и внутренняя оценки объективно свидетельствуют о деятельности лаборатории в сравнении с установленными целями.
Лаборатория должна принимать участие в трех типах внешней оценки: 1) лицензирование или аккредитация, 2) подтверждение квалификации, 3) сравнение производительности. Прежде всего, все лаборатории являются субъектами внешней оценки лицензирующих организаций (например, Centers for Medicare and Medieaid Services, в соответствии с Clinical Laboratory Improvement Amendments of 1988) или аккредетирующих организаций, таких как Joint Commission, Колледж американских патологов или Комиссия службы лабораторной аккредитации. Эти организации оценивают лаборатории относительно их соответствия опубликованным требованиям и на предмет недостатков для выявления несоответствий, которые требуют последующей корректирующей деятельности со стороны лаборатории для сохранения лицензии или аккредитации.
Вторым типом внешней оценки является квалификационное тестирование, в котором лаборатория проверяет или исследует образцы материалов, приготовленные и направленные внешней организацией, результаты при этом сравниваются с другими лабораториями, работающими похожими методами и инструментарием.
Третий тип внешней оценки лаборатории включает сравнение ее производительности по отдельным процессам, измеренной относительно других лабораторий аналогичного размера и масштаба. Колледж американских патологов поддерживает 2 такие программы: Q-PROBES и Q-TRACKS.
Лабораториям следует регулярно применять 2 способа внутренней оценки: показатели качества и лабораторный аудит. Показателями качества являются измерения производительности процессов, которые отслеживаются с помощью графических инструментов, таких как контрольные карты. Одним из примеров служит количество и источник полученных образцов, которые не соответствуют установленным лабораторией критериям приема, другим — длительность производственного цикла. В идеале лаборатория определяет один или более показателей для оценки производительности своих преаналитических, аналитических и постаналитических рабочих процессов. Многие из примеров лабораторных показателей доступны.
Аудит лаборатории — это процесс сопоставления результатов наблюдения фактического положения дел с нормативами, а также предоставление результатов сравнения менеджменту. В лабораторной сфере любой преаналитический, аналитический, постаналитический или управленческий процесс может быть подвержен аудиту для определения его соответствия установленным в лаборатории стандартам, процессам и процедурам, а также внешним регуляторным и аккредитационным требованиям. Инспекторы Колледжа американских патологов используют методы аудита для «отслеживания прохождения образцов» в лабораторных процессах во время внеплановых инспекций. Выявленные в процессе аудита данные указывают на проблемы, требующие коррекции.
Лаборатория обеспечивает услугами по взятию проб крови у больных, являющихся ее клиентами, и предоставляет результаты исследования, интерпретацию и отчеты для тех, кто осуществляет клинический уход за клиентами. Адекватная оценка и мониторинг производительности лаборатории требует существования активной обратной связи, регулярно запрашивающей указанных клиентов относительно их удовлетворенности услугами лаборатории, которыми они пользуются. Кроме того, лаборатории, которые выполняют исследования других лабораторий, используют эти лаборатории в качестве внешних клиентов. Направляющие лаборатории должны регулярно оценивать отзывы клиентов упомянутых выше лабораторий по работе с их заказами, включая показатели работы курьеров, центров обработки заказов, а также запрашивать отчеты. Используя обратную связь, следует также периодически оценивать удовлетворенность внутренних клиентов лаборатории (сотрудников).
Оценка и мониторинг показателей производительности лабораторных процессов представляют возможности для совершенствования. Вся оценочная деятельность, такая как контроль качества, подтверждение квалификации, менеджмент недопустимых событий, внешняя оценка, внутренние показатели качества, сравнение производительности, аудит качества и удовлетворенность клиентов, обеспечивается обратной связью, информирующей относительно текущих или потенциальных (в случае, если не будут предприняты превентивные меры) проблем на преаналитическом, аналитическом и постаналитическом этапах.
Лаборатории необходимо подготавливать информацию относительно оценочной активности в виде периодического отчета, который пересматривает менеджмент лаборатории с определением приоритетов в отношении заданий усовершенствования и распределения для этого ресурсов. Для выполнения конкретных задач должны быть организованы и назначены так называемые команды по усовершенствованию. Для выявления причин проблем и определения потенциальных решений существует ряд различных инструментов качества.
Инструменты качества немедицинской производственной сферы были адаптированы для улучшения процессов здравоохранения, включая методы Анализ возможных неполадок и их последствий, Lean, а также Six Sigma. Анализ возможных неполадок и их последствий — инструмент, используемый для анализа действий в ходе процесса для параметров уязвимости, потенциальных и фактических рисков или неполадок. Баллы по вероятности выявления неполадок, возможности возникновения инцидентов и тяжести последствий определяются, подсчитываются и располагаются в приоритетной последовательности. Для уменьшения или устранения рисков и улучшения результатов осуществляется корректировка процесса.
Lean — это набор принципов, с помощью которых стремятся устранить ненужные траты в ходе процесса, впервые примененный и затем формализованный в Toyota Production System. Производители медицинской аппаратуры и производственные консультанты сейчас предлагают консалтинговую услугу Lean в связи с тем, что многие лаборатории осознали, что более эффективная производительность означает повышение возможности проведения большего количества исследований в лаборатории, зачастую без привлечения дополнительных ресурсов. Инструменты и принципы Lean также активно применяются для устранения проволочек, перегруженности и разочарований, связанных с существующей системой здравоохранения.
Six Sigma — это методология, которая использует доказанные принципы и технику качества для снижения колебания параметров и уменьшения количества ошибок для достижения уровня 6о — не более 3,4 отклонения на миллион операций таким образом, что может быть достигнуто согласие с требованиями и критическими факторами удовлетворенности клиента. Пять основных видов деятельности любой программы Six Sigma (определять, оценивать, анализировать, улучшать и контролировать) включают оценку, статистический анализ и регулировку для соединения воедино качества, стоимости, процессов, людей и отчетности. Методология Six Sigma успешно применяется в автоматизированной лабораторной сфере и в целом в здравоохранении. Сравнение процентов ошибок для некоторых преаналитических, аналитических и постаналитических процессов лаборатории демонстрирует, что лабораторные процессы еще не достигли целевых 6о.
Комбинация методов Lean и Six Sigma используется как в процессах здравоохранения, так и в медицинских лабораториях. Ее применение увеличивается, как сообщается в журналах сферы здравоохранения, периодических изданиях, посвященных лабораторному делу, а также в Интернет-публикациях. Многочисленные возможности для физических лиц получить сертификаты по методикам Lean и Six Sigma доступны для заинтересованных сотрудников лабораторий; обширная информация содержится в Интернете.
Двенадцать QSE содержат систематический подход к управлению качеством, который обеспечивает соответствие лаборатории всем предъявляемым требованиям в рамках выполнения повседневной преаналитической, аналитической и постаналитической деятельности. К сожалению, существует распространенное допущение, что только методы Анализа возможных неполадок и их последствий, Lean и Six Sigma решат проблемы качества как в лаборатории, так и в системе здравоохранения. Однако это всего лишь отдельные инструменты для временного улучшения только одного рабочего процесса. Эти три инструмента могут и должны быть применены при контроле процессов QSE, когда лаборатория разрабатывает новый процесс (например, в случае добавления новой услуги к диагностическому исследованию). Большинство лабораторий используют эти инструменты качества только для выявленных проблем, однако тем самым упускают возможность получить изначально спроектированные, задокументированные, утвержденные и приведенные в исполнение процессы, оптимальные для выявления какой-либо одной проблемы и всех в целом, действительно возникающих перед внедрением.
Более того, ни программы Всеобщего управления качеством и непрерывного совершенствования качества, ни программа Plan-Do-Check-Act (Планируй-Выполняй-Проверяй-Воздействуй – циклически повторяющийся процесс принятия решения, используемый в управлении качеством; представляет собой простейший алгоритм действий руководителя по управлению процессом и достижению его целей), популярные в 1990-х годах, не решают проблемы медицинских ошибок, наносящих вред пациенту и приводящих к его смерти, что так четко задокументировано в новейшей истории. Это может свидетельствовать о том, что причиной подобных неудач были не сами инструменты (используемые должным образом указанные выше инструменты действительно приводят к улучшениям), а скорее то, что их использовали отдельно, вместо того чтобы внедрить в систему качества.
Чего не хватает многим лабораториям, так это принципиального, фундаментального подхода к качеству, где желаемый уровень и показатели производственного процесса составляли бы часть процесса каждой лаборатории, а именно:
Подобный подход, который наиболее успешно интегрирует все нормативные и аккредитационные требования, обязательства перед клиентом, безопасность пациента, проектирование, оценку и мониторинг технологического процесса, а также улучшения, состоит во внедрении QMS так, как было описано выше в модели 12-QSE, которая поддерживает полный лабораторный цикл от преаналитического и аналитического до постаналитического производственных этапов.
Эта модель носит основополагающий характер и применима в лабораториях любого размера, масштаба или специализации где бы то ни было в мире. Она также считается достаточно простой, чтобы быть адаптированной для применения в странах Африки при поддержке Программы чрезвычайных действий по сокращению ВИЧ/СПИД администрации президента США. Несколько лабораторий в США и Канаде успешно применяют данную модель для внедрения процесса управления качеством как средства для достижения совершенствования процесса и безопасности пациентов, а также готовности к внеплановым инспекциям. Эти лаборатории сообщают о значительном уменьшении количества недостатков, которые обнаруживают инспекции по аккредитации и снижении затрат на технологические сбои, таких как ошибки, допускаемые при взятии проб.
Во всех источниках по немедицинской индустрии, в литературе по качеству и во всех рекомендациях организаций, отмеченных наградой Malcolm Baldrige, администрация является ключевым элементом в организации мероприятий по улучшению качества. Руководство задает тон и определяет культуру качества в любом учреждении. Сотрудники следят за руководством в отношении директив и выполнения указаний, и при отсутствии того и другого качество низводится к выполнению минимальных требований.
В большинстве лабораторий существует два вида руководства: медицинское и административное. Оба нужны для поддержания устойчивой культуры управления качеством в условиях медицинской лаборатории. Административный менеджмент лаборатории должен быть сосредоточен на определении стандартов, процессов и процедур в отношении QSE, устранении препятствий, которые мешают сотрудникам выполнять рационально и эффективно поставленные задачи. Не менее важная роль руководства медицинских патоморфологов состоит в обеспечении того, чтобы стандарты, процессы и процедуры преаналитических, аналитических и постаналитических производственных процессов соответствовали техническим требованиям и выдавали клинически релевантные, точные результаты и интерпретации для клиентов лаборатории в целях их излечения.
Положения QSE и ряд рабочих операций требуют постоянного сотрудничества как административного, так и медицинского руководства. Модель QMS, описанная в настоящей статье и изображенная на рис. 2, предусматривает план, в котором это сотрудничество может успешно обеспечивать наиболее достойный вклад лаборатории в излечение пациента и обеспечение его безопасности.
Lucia М. Berte, MA, MT(ASCP)SBB, DLM, CQA(ASQ)CQM/OE
С началом выполнения скрининговых программ для выявления рака шейки матки (РШМ) заболеваемость...
Турция это одно из самых популярных в мире направлений медицинского туризма. Турция...
LiV Hospital объединяет в себе сфокусированное на пациенте видение - команду избранных...
в Стамбуле оказывает медицинские услуги в течение 20 лет. Расположен в Анатолийской...
Анталия – прекрасный регион с солнцем, морем, природой и тысячелетней...
анализы, БАД, биологическая медицина, витамины, гастроэнтерология, гигиена, гинекология, гомеопатия, дерматология, диагностика, диетология, заболевания, иммунология, инфекционные заболевания, инфекция, исследования, кардиология, кожа, косметика, красота, лекарственные растения, лечение, лицо, неврология, обследование, оздоровление, онкология, ортопедия, педиатрия, питание, пищеварительная система, поведение, похудение, препараты, продукты, профилактика, процедура, психология, пульмонология, рак, реабилитация, сердечно-сосудистая система, ССС, тело, терапия, травматология, уход, фитотерапия, хирургия, эндокринология
Показать все теги

Комменатрии к новости