Вкусно есть и долго жить
Эффективное пищеварение – основа жизненных процессов. В условиях нарушенного пищеварения...
Медицина / Патология / Патология (статья)
 AnemiaДефицит витамина В12 (ДВ12) — патологическое состояние, характеризующееся недостаточным содержанием метаболически активных форм витамина В12 (вВ12), которое развивается вследствие его неадекватного поступления с пищей, нарушения всасывания или транспорта в организме. Сходные метаболические нарушения и клинические симптомы развиваются при наличии врожденных дефектов некоторых внутриклеточных ферментов, участвующих в метаболизме витамина В12, и образовании его метаболически активных форм.
AnemiaДефицит витамина В12 (ДВ12) — патологическое состояние, характеризующееся недостаточным содержанием метаболически активных форм витамина В12 (вВ12), которое развивается вследствие его неадекватного поступления с пищей, нарушения всасывания или транспорта в организме. Сходные метаболические нарушения и клинические симптомы развиваются при наличии врожденных дефектов некоторых внутриклеточных ферментов, участвующих в метаболизме витамина В12, и образовании его метаболически активных форм.
В развитии дефицита витамина В12 выделяют несколько этапов:
Наиболее характерным клиническим проявлением дефицита В12 является вВ12-дефицитная анемия (В12ДА), которая относится к межобластным анемиям (МА), связанным с нарушением синтеза ДНК. Это большая группа приобретенных и наследственных заболеваний, общим признаком которых является наличие в костном мозге характерных клеток — мегалобластов. Вследствие происходящего при дефиците витамина В12 нарушения нормального кроветворения в периферической крови появляются эритроциты большего, чем в норме, размера (макроциты). Поэтому анемия при изолированном дефиците витамина В12 является макроцитарной. Следует отметить, что существуют и другие причины мегалобластной и макроцитарной анемий, не связанные с дефицитом витамина В12.
Витамин В12 — водорастворимый кобальтсодержащий витамин, играющий важную роль в нормальном функционировании костного мозга и нервной системы. Витамин В12 принято называть кобаламином. Кобаламины — группа молекул, имеющих структурное сходство и различающихся структурой лиганда, соединенного с атомом кобальта. Различают цианокобаламин, имеющий лиганд цианид (-CN), гидроксикобаламин, содержащий гидроксильную группу (-ОН), метилкобаламин — метильную группу (-СНЗ) и аденозилкобаламин, содержащий 5'-деоксиаденозил. Кобальт, входящий в состав кобаламинов, может находиться в одно-, двух- и трехвалентной формах. Цианокобаламин в природе не содержится, возникает как артефакт при выделении либо его синтезируют искусственно для профилактики и лечения дефицита витамина В12. Гидроксикобаламин продуцируется бактериями и используется как лекарственный препарат (реже цианокобаламина). В организме человека кобаламин существует в двух активных формах: аденозилкобаламин (кофактор метилмалонил-КоА мутазы) и метилкобаламин (кофактор метионинсинтетазы; в некоторых странах используют как препарат). Цианокобаламин и гидроксикобаламин превращаются в эти формы в результате метаболической конверсии in vivo. Цианокобаламин — наиболее устойчивая форма витамина В12 во внешней среде.
Источниками витамина В12 в природе являются кобаламинпродуцирующие микроорганизмы (бактерии, грибы и водоросли). В организме человека отсутствуют ферментные системы для синтеза этого витамина — он поступает исключительно с пищей животного происхождения. У жвачных животных витамин В12 синтезируется в желудке кобаламинпродуцирующими микроорганизмами и накапливается в мышечной ткани и паренхиматозных органах. В толстом кишечнике человека происходит синтез витамина В12 микроорганизмами, однако эта область находится дистальнее участков его физиологического всасывания. Пищевой кобаламин устойчив к высокой температуре, однако может инактивироваться под действием аскорбиновой кислоты.
В среднем за сутки в организм человека поступает 5-7 мкг витамина В12. В организме взрослого человека содержится 2-5 мг кобаламина в виде коэнзимных форм (метил- и аденозилкобаламина), причем около 1-1,5 мг из них — в печени (депо). Суточные потери этого витамина составляют около 0,1% запасов. Таким образом, при нарушении всасывания витамина В12 запасы этого витамина могут истощиться в течение 3-4 лет. Однако при недостатке витамина В12 в пище это происходит несколько позднее вследствие существования энтеропеченочной циркуляции кобаламина, благодаря которой из кишечника повторно всасывается около 5-10 мкг витамина В12 в сутки. В природе существует значительное количество аналогов кобаламина (псевдовитамины В12), имеющих структурное сходство с витамином В12. Вследствие отличий в структуре корринового ядра либо нуклеотидной части аналоги кобаламина не участвуют в метаболических реакциях кобаламинов. Аналоги кобаламина продуцируются некоторыми микроорганизмами, образуются в результате химических взаимодействий кобаламинов в природе либо возникают как продукты метаболизма кобаламинов in vivo.
Дефицит витамина В12 более распространен среди населения, чем считалось до сих пор, особенно среди лиц пожилого возраста, вегетарианцев, беременных и пациентов терапевтических, неврологических и психиатрических стационаров. Поскольку недостаток этого витамина может привести к необратимым неврологическим нарушениям, ранняя диагностика данного состояния является актуальной. В последние годы появились новые чувствительные и специфические маркеры дефицита витамина В12, которые становятся более доступными в клинической практике и позволяют проводить более точные эпидемиологические исследования.
В проведенных за последние 10 лет эпидемиологических исследованиях были использованы различные определения дефицита витамина В12. В настоящее время отсутствуют четкие критерии и золотой стандарт диагностики этого патологического состояния, поэтому его распространенность, по данным разных исследователей, несколько отличается.
Наиболее обоснованными и часто используемыми являются следующие критерии диагностики дефицита витамина В12:
Среди пациентов, находящихся на стационарном лечении, дефицит витамина В12 при использовании вышеуказанных критериев диагностики выявляют в среднем у 5%.
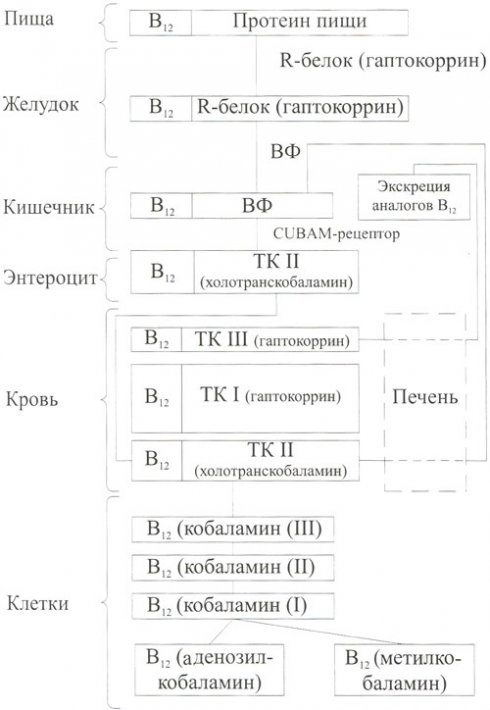
В норме витамин В12 поступает в организм с животной пищей в виде аденозилкобаламина или метилкобаламина, которые неспецифически связаны с белками (рис. 1). В желудке под действием пепсина и соляной кислоты витамин В12 освобождается от пищевых белков и соединяется с R-белком (гаптокоррин, кобалафилин) слюны и желудочного сока. Этот процесс имеет важное клиническое значение, так как у 25-50% лиц старше 70 лет есть гипохлоргидрия и ахлоргидрия, вследствие которых нарушается освобождение кобаламина, связанного с пищевыми белками. Всасывание кристаллического витамина В12 (цианокобаламина) у этих лиц нормальное. Данное патологическое состояние можно выявить с помощью модифицированного теста Шиллинга, при котором используют меченый кобаламин, входящий в состав пищевого белка.
 Всасывание и транспорт витамина В12
Всасывание и транспорт витамина В12
Рис. 1. Всасывание и транспорт витамина В12
После расщепления пищи в желудке кобаламин связывается преимущественно с R-белком (см. рис. 1), имеющим в кислой и нейтральной среде большую аффинность к витамину В12, чем внутренний фактор (ВФ). Внутренний фактор — гликопротеин, вырабатываемый париетальными клетками дна и тела желудка и секретируемый в активном состоянии в просвет желудка. ВФ имеет два связывающих сайта: один — с витамином В12, другой — со специфическим рецептором кишечника. Внутренний фактор играет важнейшую роль в механизме всасывания витамина В12 и в норме секретируется в количествах, значительно превышающих потребность для абсорбции кобаламина. Количество ВФ, содержащегося в 2-4 мл нормального желудочного сока, достаточно для компенсации дефицита витамина В12 при его недостатке. При отсутствии внутреннего фактора всасывается менее 2% витамина В12, содержащегося в пище, а при его наличии — около 70%. ВФ секретируется в ответ на поступление пищи в желудок, и его выработка регулируется аналогично выработке соляной кислоты (т. е. при участии блуждающего нерва и гормональной стимуляции). Однако имеется отличие: секреция ингибируется длительным приемом Н2-блокаторов, но не зависит от приема блокаторов протонной помпы. Однако длительный прием ингибиторов протонной помпы может приводить к значимой ахлоргидрии и снижению всасывания кобаламина, связанного с пищевыми белками.
Далее витамин В12, связанный с R-белком, поступает в двенадцатиперстную кишку. Под действием панкреатических протеаз R-белок, как связанный, так и не связанный с витамином В12, подвергается деградации, внутренний фактор остается интактным. Деградация R-белка приводит к уменьшению его сродства к витамину В12 более чем в 150 раз. После расщепления в двенадцатиперстной кишке R-белка, связанного с витамином В12, панкреатическими протеазами высвободившийся витамин В12 связывается в течение 10 мин с ВФ (см. рис. 1), поступившим из желудка. Внутренний фактор также связывается с витамином В12, поступившим в двенадцатиперстную кишку с желчью (энтеропеченочный кругооборот витамина В12). Примерно у 30% пациентов с недостаточностью поджелудочной железы нарушено всасывание витамина В12, поскольку не происходит расщепления комплекса R-белок-вВ12.
Щелочная среда в двенадцатиперстной кишке усиливает связь внутреннего фактора с витамином В12, в результате чего комплекс ВФ-вВ12 в форме олигомеров или димеров пассивно продвигается через тощую к подвздошной кишке, где расположена группа специфических рецепторов к этому комплексу: кубулин (cubilin, CUBN), amnionless (AMN), receptor-associated protein (RAP) и megalin (LRP-2). Непосредственно рецептором комплекса ВФ-вВ12 является комплекс cubilin-amnionless (CUBAM) (см. рис. 1). Однако участие других рецепторов также существенно, хотя мало изучено. Кубулин располагается во впадине микроворсинок слизистой оболочки подвздошной кишки. Аналогичные рецепторы обнаружены на щеточной кайме проксимального отдела почечных канальцев. Кубулин выявлен на слизистой оболочке всей тонкой кишки, однако максимальное его количество определяют в области терминального отдела подвздошной кишки. Рецептор CUBAM специфичен к комплексу ВФ–вВ12 и совсем не связывается с несвязанным внутренним фактором, свободным витамином В12 и комплексом Н-белок-вВ12. Аналоги кобаламина, поступившие с пищей или с желчью в двенадцатиперстную кишку и связанные с Р-белком, не переходят к ВФ и экскретируются с калом.
Незначительная (около 1-5%) часть витамина В12 (в свободном или в кристаллическом виде) может всосаться пассивной диффузией по ходу всего кишечника без участия внутреннего фактора. Этот механизм срабатывает при приеме витамина В12 в высоких дозах (выше 1000 мг). Этим же объясняется терапевтический эффект перорального приема витамина В12, в том числе у больных с пернициозной анемией (ПА) при отсутствии секреции внутреннего фактора.
Механизм переноса витамина В12 энтероцитами в кровоток не изучен. Поданным некоторых исследователей, после связывания комплекса ВФ-вВ12 со специфическим рецептором весь комплекс путем эндоцитоза проникает внутрь энтероцита. После проникновения комплекса ВФ-вВ12 внутрь энтероцита он распадается и внутренний фактор деградирует, а кобаламин поступает в интрацеллюлярное пространство энтероцита. По данным других исследователей, внутрь энтероцита проникает только кобаламин.
В дальнейшем внутри или на базальной поверхности энтероцита кобаламин связывается с белком-переносчиком транскобаламином II (ТК II) и поступает в воротный кровоток печени. Этот комплекс, называемый холотранскобаламином (holotranscobalamin; см. рис. 1), является основной формой переноса метаболически активного витамина В12 в организме. ТК II в течение 6-8 мин исчезает из кровотока, связываясь со специфическими рецепторами в различных тканях. Около 10-30% циркулирующего витамина В12 связаны сТК II. Большая часть витамина В12, находящегося в крови, связана с транскобаламином I (ТК I, гаптокоррин), меньшая — с транскобаламином III (ТК III). ТК I не является транспортным белком, связанный с ним кобаламин находится в циркуляции в течение 9-12 дней. Физиологическая роль ТК I до конца не установлена. Вероятно, он является плазменным депо витамина В12. ТК III выполняет функции транспортного белка, так как удаляется из крови в течение 3 мин, связываясь с сиалогликопротеиновыми рецепторами в печени. При этом кобаламин экскретируется с желчью в кишечник. Фунционально ТК III связывает большой спектр аналогов витамина В12 (псевдовитамины В12) и экскретирует их с желчью для удаления из организма с калом. В то же время от 0,5 до 9 мкг кобаламина, связанного с ТК II, посредством связывания последнего со специфическими рецепторами гепатоцитов поступает с желчью в кишечник. В результате существующего энтеропеченочного кругооборота кобаламина повторно всасывается около 65-75% выделившегося с желчью витамина В12. Печень — основной орган, в котором накапливается витамин В12. Почки являются важным органом, регулирующим запасы витамина В12 в организме и его уровень в крови.
Поглощение тканями комплекса ТКИ—вВ12 осуществляется при участии рецептора «megalin-ТКИ рецептор». Опосредованный этим рецептором эндоцитоз играет ключевую роль в гомеостазе кобаламина. ТК II несет ответственность за клеточное поглощение витамина В12 в большинстве тканей, его дефицит связан с тяжелой межобластной анемии. Следует отметить, что мегалин и кубулин не являются рецепторами, специфичными только для абсорбции и поглощения тканями кобаламина. Они являются также рецепторами для альбумина, трансферрина и многих других белков.
После поглощения клеткой комплекс ТКИ—вВ12 находится внутри лизосомы, где в кислой среде происходит его диссоциация (рис. 2). Внутренний фактор в дальнейшем деградирует, а кобаламин поступает во внутриклеточное пространство и превращается в коэнзимные формы. Более 95% внутриклеточного кобаламина связывается с двумя внутриклеточными ферментами: метилмалонил-КоА мутазой (ММКоАМ) и метионинсинтетазой, имеющими критическое значение для синтеза ДНК, РНК и биосинтеза белков. Витамин В12 поступает внутрь клетки в неактивной форме в виде кобаламина (III). В дальнейшем под действием редуктаз он превращается в кобаламин (II) и далее — в кобаламин (I).
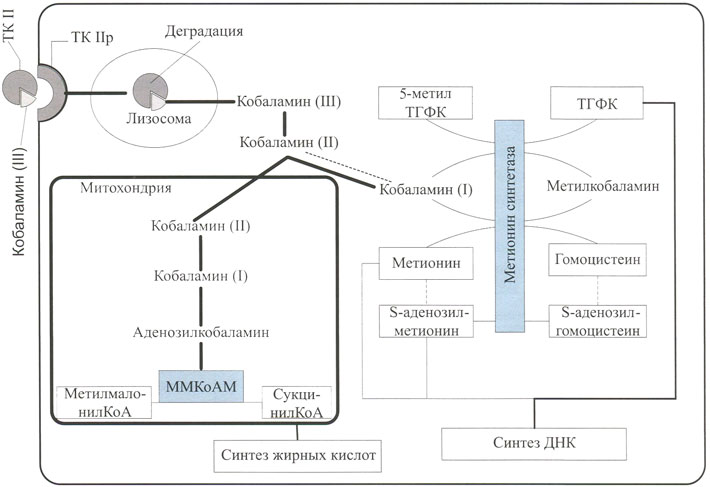
Рис. 02. Участие витамина В12 во внутриклеточном метаболизме
В митохохондриях кобаламин (I) превращается в коэнзимную форму — аденозилкобаламин (см. рис. 2). Метилмалонил-КоА мутаза в присутствии аденозилкобала- мина превращает метилмалонил-КоА в сукцинил-КоА. Эта реакция играет важную роль в метаболизме пропионата и синтезе жирных кислот.
В цитоплазме кобаламин в виде метилкобаламина функционирует как коэнзим в реакциях метионинсинтетазы, которая катализирует перенос метильной группы от метилкобаламина к гомоцистеину с образованием метионина (см. рис. 2). При этом метилкобаламин превращается в кобаламин (I). Метил-группа 5-метилтетрагидрофолиевой кислоты (5-метилТГФК) в свою очередь является донором метильной группы для кобаламина (I) с регенерацией метилкобаламина. 5-МетилТГФГ при этом превращается в тетрагидрофолиевую кислоту (ТГФК). Метионинсинтетаза также катализирует конверсию S-аденозилметионина в S-аденозилгомоцистеин, что обусловлено структурной особенностью метионинсинтетазы, которая имеет четыре связывающих участка: с гомоцистеином, 5-метилТГФК, кобаламином и Б-аденозилметионином.
Механизмы, по которым развиваются мегалобластные изменения в клетках при дефиците витамина В12, до конца не известны. Общепризнанным фактом является то, что недостаток витамина В12 приводит к развитию функционального внутриклеточного дефицита 5,10-метилентетрагидрофолевой кислоты (5,10-метиленТГФК) (рис. 3). 5,10-метиленТГФК во внутриклеточных реакциях может использоваться по двум направлениям. В цикле тимидилата при участии тимидилатсинтазы (2 на рис. 3) из дезоксиуридинмонофосфата (dUMF) образуется дезокситимидинмонофосфат (dTMF), используемый в синтезе ДНК. При участии метилентетрагидрофолатредуктазы (1 на рис. 3) образуется 5-метилТГФК, используемая в метилатном цикле. Оба эти пути являются крайне важными, особенно для синтеза ДНК.
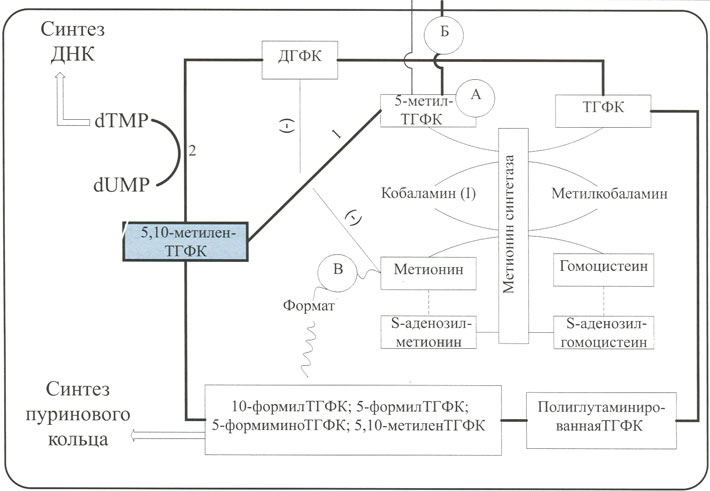
Рис. 3. Патогенез мегалобластных изменений в клетках
Основной формой хранения фолиевой кислоты внутри клетки является полиглутаминированная ТГФК, образующаяся изТГФГ при участии фолиполиглутаматсинтазы. Именно полиглутаминированная ТГФК является источником образования активных внутриклеточных форм фолиевой кислоты. Согласно гипотезе «метилфолатной ловушки» (пункт А на рис. 3), в результате нарушения функционирования метионинсинтетазы образуется избыточное количество 5-метилТГФК. В связи с тем, что 5-метилТГФК может проникать через клеточную мембрану, клетка теряет эту форму фолиевой кислоты (пункт Б на рис. 3), вследствие чего прекращается образование ТГФГ, ее полиглутаминированной формы и развивается внутриклеточный дефицит метаболитов фолиевой кислоты. Поскольку активность метилтетрагидрофолатредуктазы регулирует количество метионина, при его недостатке предпочтительным путем метаболизма 5,10-метиленТГФК является путь 1, приводящий к избыточному образованию 5-метилТГФК (см. рис. 3).
Согласно гипотезе «форматного голода» недостаточное образование метионина при дефиците витамина В12 приводит к уменьшению образования формата, необходимого для нормального метаболизма активных форм фолиевой кислоты (пункт В на рис. 3). В первую очередь нарушается синтез 5-формилТГФК и 10-формилТГК, а затем возникает внутриклеточный дефицит 5,10- метиленТГФК, играющей ключевую роль в синтезе ДНК (см. рис. 3).
Витамин В12 в виде метилкобаламина является необходимым коферментом метионинсинтетазы и при его отсутствии 5-метилТГФК не может превратиться в ТГФК и ее производные, не в состоянии полиглутамироваться и сохраняться внутри клетки. В результате этого возникает дефицит в первую очередь 5,10-метиленТГФК (см. рис. 3), необходимой для превращения дезоксиуридинмонофосфата в дезокситимидинмонофосфат. Это является основной причиной нарушения синтеза ДНК. Недостаток синтеза пуриновых нуклеотидов может быть частично компенсирован уменьшением их распада. Недостаточное образование полиглутаминированной формы ТГФК приводит к уменьшению образования 10-формилтетрагидрофолиевой кислоты (10-формилТГФК) и снижению синтеза пуринов de novo. Полиамины, образующиеся из S-аденозилметионина, также играют важную роль в синтезе ДНК, однако механизмы этого еще не до конца изучены (см. рис. 3).
В связи с тем, что и дефицит витамина В12, и дефицит фолиевой кислоты приводят в конечном счете к развитию функционального внутриклеточного дефицита коэнзимных форм фолиевой кислоты, возникающие при этих двух состояниях мегалобластные изменения в клетках являются идентичными. Однако только для дефицита витамина В12 характерна пятнистая демиелинизация серого вещества в головном и спинном мозге и в периферических нервах, что обусловливает развитие различных церебральных аномалий и подострой комбинированной дегенерации спинного мозга (фуникулярный миелоз).
Патогенез этих изменений окончательно не установлен. Большинство исследователей и клиницистов связывают их с нарушением превращения в митохондриях метилмалонил-КоА в сукцинил-КоА при участии метилмалонил-КоА мутазы, коферментом которой является аденозилкобаламин (см. рис. 2). Метилмалонил-КоА — конечный метаболит при распаде жирных кислот с нечетным числом углеродных атомов. При дефиците витамина В12 метилмалонил-КоА накапливается в избыточном количестве в клетках (является токсичным) и включается в синтез жирных кислот (которые становятся аномальными). Миелин оболочки нервных клеток является структурным элементом, который состоит на ¾ из липидов (во всех остальных структурных элементах клеток организма доля липидов меньше), поэтому нарушение метаболизма жирных кислот в первую очередь возникает именно в нем.
Другим важным фактором развития неврологической симптоматики при дефиците витамина В12 является дефицит метионина вследствие нарушения функционирования метионинсинтетазы (см. рис. 2). Значение этого пути доказано данными клинических исследований, свидетельствующими о наличии достоверной положительной корреляции между выраженностью неврологической симптоматики и повышением уровня в сыворотке крови не только метилмалоновой кислоты, но и гомоцистеина. Кроме того, наследственные дефекты метионинсинтетазы, как правило, приводят к развитию неврологических нарушений, в то время как для наследственных дефектов метилмалонил-КоА мутазы неврологические нарушения нехарактерны.
В зависимости от этиологии и патогенеза выделяют следующие причины дефицита витамина В12:
I. Дефицит витамина В12 в пище:
- вегетарианство;
- период беременности;
- несбалансированное питание.
II. Неадекватное высвобождение витамина В12 из пищевых белков:
- атрофический гастрит;
- гипохлоргидрия;
- длительный прием блокаторов протонной помпы и Н2-блокаторов.
III. Дефицит внутреннего фактора:
- наследственный дефицит и аномалии внутреннего фактора;
- гастрэктомия;
- пернициозная анемия;
- химическое повреждение слизистой оболочки желудка.
IV. Внутрикишечные нарушения всасывания витамина В12:
- недостаточное образование или инактивация панкреатических протеаз;
- конкурентное потребление вВ12 в кишечнике бактериями или паразитами.
V. Патология кишечной стенки и рецепторов к комплексу ВФ-вВ12:
- уменьшение или отсутствие рецепторов к комплексу ВФ-вВ12 (кишечный анастомоз, резекция кишечника, фистула);
- дефекты рецепторов к комплексу ВФ-вВ12 (синдром Имерслунд-Гресбека, дефицит ТК II);
- патологические изменения в стенке кишечника:
а) спру;
б) целиакия (нетропическое спру);
в) болезнь Крона;
г) туберкулезный илеит;
д) лимфома с поражением стенки кишечника;
е) амилоидоз;
ж) медикаментозное нарушение всасывания витамина В12 в кишечнике.
VI. Нарушение транспорта витамина В12 в плазме крови:
- наследственный дефицит ТК II;
- нарушение образования комплекса TK II—вВ12.
VII. Изолированное нарушение внутриклеточного метаболизма витамина В12:
- врожденные дефекты ферментных систем;
- приобретенные нарушения (вдыхание NO2).
Недостаточное поступление витамина В12 является редкой причиной развития клинически значимого дефицита витамина В12. По данным N. Dali-Youcef и Е. Andres, пищевая недостаточность кобаламина является причиной дефицита витамина В12 лишь у 2% пациентов пожилого возраста в развитых странах.
Дефицит кобаламина при нарушении диеты развивается обычно у вегетарианцев, которые полностью избегают употребления продуктов животного происхождения (даже яиц и творога). Вегетарианские диеты могут быть классифицированы как лактовегетарианские (включают молочные продукты), ововегетарианские (включают яйца), лактоововегетарианские (включают молочные продукты и яйца) и веганские (исключают любые продукты животного происхождения). Веганские диеты характеризуются наиболее низким содержанием кобаламина.
Невегетарианцы в развивающихся странах, потребляющие продукты животного происхождения нерегулярно и в недостаточном количестве из-за дороговизны, также относятся к группе риска в отношении развития дефицита витамина В12.
У лиц с повышенной потребностью в витамине В12 (женщины в период беременности и кормления грудью, пациенты с аутоиммунными заболеваниями или лица с ВИЧ-инфекцией) также существует высокий риск возникновения дефицита витамина В12.
По данным зарубежных авторов, дефицит витамина В12 часто выявляют у пациентов психиатрических стационаров (анорексия, строгое вегетарианство) и у больных пожилого возраста, длительно пребывающих в закрытых учреждениях.
У лиц, проживающих в развитых странах и в Украине, дефицит витамина В12 чаще развивается не вследствие недостатка витамина В12 в пище, а в результате нарушения его всасывания. По данным N. Dali-Youcef и E. Andres, нарушение всасывания кобаламина является причиной развития дефицита у 87% пациентов пожилого возраста с дефицитом витамина В12, причем у 53-60% из них вследствие синдрома мальабсорбции пищевого кобаламина.
Впервые этот синдром был описан Кармелем в 1995 г. Он характеризуется неспособностью организма освобождать кобаламин из пищи при нормальном всасывании несвязанного (кристаллического) кобаламина, недостаточностью витамина В12 при нормальном содержании кобаламина в пище, нормальном тесте Шиллинга и исключении ПА. При этом синдроме пациенты могут поглощать несвязанный кобаламин посредством внутреннего фактора или в результате пассивной диффузии. Выявление данного синдрома обосновывает пероральный прием витамина В12. Для его диагностики используют тест Шиллинга, при котором применяют радиоактивный кобаламин, внедренный в животные белки (например, в лосось, форель).
Клинически дефицит витамина В12 при синдроме мальабсорбции пищевого кобаламина характеризуется менее выраженной клинической картиной. Тем не менее встречаются и случаи, сопровождающиеся полинейропатией, спутанностью сознания, слабоумием, подострым дегенеративным склерозом, анемией и панцитопенией. Частичный характер мальабсорбции при этом синдроме приводит к более медленно прогрессирующему истощению кобаламина, чем при полной мальабсорбции, обусловленной отсутствием внутреннего фактора.
Характерен прежде всего атрофический гастрит. Более чем у 40% лиц старше 80 лет имеется атрофия слизистой оболочки желудка, которая может быть как связана, так и не связана с инфицированием H. pylori. Атрофия желудка ассоциирована с ахлоргидрией, при которой значительно снижается протеолитическая активность пепсина и нарушается высвобождение витамина В12 из пищевых белков. Эта патология является причиной возникновения дефицита витамина В12 у 30% пациентов. К нарушению всасывания витамина В12 у пожилых людей могут приводить хроническое носительство H. pylori и повышенный бактериальный рост в кишечнике. Инфицирование H. pylori выявляют у 56% больных с дефицитом витамина В12. У этих пациентов дефицит витамина В12 может быть купирован после антибактериальной терапии. У 40% пациентов с дефицитом витамина В12 и инфицированием H. pyloriконцентрация витамина В12 в сыворотке крови нормализуется после антихеликобактерной терапии. По последним данным, лечение инфицирования H. pylori в течение года способствует значительному повышению средней концентрации витамина В12 (от 146 до 271 мкмоль/л) и снижению средней концентрации общего гомоцистеина (от 41 до 13 мкмоль/л). Длительный прием антацидов (Н2-блокаторов, ингибиторов протонной помпы), особенно у пациентов с синдромом Золлингера-Эллисона, а также бигуанидов (метформин) приводит к дефициту витамина В12 у 20% пациентов. Развитие дефицита витамина В12 может обусловить хронический алкоголизм, сопровождающийся атрофическим гастритом и ахлоргидрией.
Наследственное нарушение секреции внутреннего фактора (наследственная пернициозная анемия (ПА) описано у небольшого количества пациентов. Заболевание возникает вследствие мутации в гене GIF (68A®G) 11-й хромосомы, наследуется по аутосомно-рецессивному типу и характеризуется дефицитом или полным отсутствием секреции ВФ клетками желудка. У детей в возрасте 6 мес показатели крови нормальные за счет витамина В12, поступившего от матери. Заболевание обычно проявляется в возрасте от 6 мес до 5 лет, но может быть диагностировано и в более поздний период. Ребенок худеет, у него исчезает аппетит, появляются восковая бледность, часто желтизна склер и кожи. Характерны геморрагические высыпания на коже и слизистых оболочках, частые рецидивирующие инфекции. Секреция соляной кислоты и пепсина не нарушена, структура слизистой оболочки желудка нормальная. Появляется характерная для дефицита витамина В12 неврологическая симптоматика. Иногда резко снижаются спинальные рефлексы вплоть до атаксии. При обследовании выявляют картину MA, уровень сывороточного кобаламина резко снижен, отсутствуют антитела к париетальным клеткам желудка и ВФ. Всасывание меченого витамина В12 также снижено. Прием нормального нейтрализованного желудочного сока или ВФ нормализует всасывание. Описаны случаи дефицита витамина В12, при которых содержание внутреннего фактора нормальное, однако имеется нарушение его структуры, приводящее к нарушению нормального всасывания витамина В12. Клиническая картина аналогична вышеописанной.
В редких случаях (у 1% пациентов с дефицитом витамина В12) причиной заболевания являются резекция желудка или реконструктивные операции на желудке (например, шунтирование при ожирении). Дефицит витамина В12 в этих случаях развивается вследствие утраты значительного количества париетальных клеток, находящихся в теле и дне желудка, и значительного уменьшения или полной невозможности образования ВФ.
Пернициозная анемия является наиболее частой причиной недостаточности витамина В12, ее выявляют в среднем у 33% пациентов с дефицитом витамина В12. ПА, известная как болезнь Аддисона-Бирмера, является макроцитарной анемией, развивающейся вследствие дефицита витамина В12, обусловленного недостаточным образованием и секрецией внутреннего фактора. Дефицит ВФ — следствие атрофического гастрита типа
А, который характеризуется разрушением слизистой оболочки дна и тела желудка с потерей париетальных клеток, которые обычно вырабатывают соляную кислоту и ВФ.
Ранее считали, что пернициозная анемия особенно распространена среди жителей скандинавских стран, Англии или Ирландии и гораздо реже встречается у лиц, проживающих на Кавказе, в Италии и Греции. Тем не менее, в последнее время ПА зарегистрирована у афроамериканцев и латиноамериканцев. Ее часто выявляют в США, Турции, Италии и даже в Японии. Причина неоднородного распределения пернициозной анемии между различными этническими группами пока не известна, но, вероятно, заключается в различном генетическом фоне. Заболевание ежегодно диагностируют у 25 на 100 000 населения старше 40 лет. По результатам недавно проведенных исследований установлено, что у 1,9% лиц старше 60 лет имеется недиагностированная ПА.
Ранее сообщалось о более частом развитии ПА у женщин. Это преобладание было отмечено по данным обследования лиц старше 60 лет, поведенном в Калифорнии: распространенность ПА среди женщин составила 2,7%, среди мужчин — 1,4%. Однако по данным других исследователей, такого преобладания не выявлено.
Пернициозная анемия часто описывают как болезнь пожилых людей. Средний возраст больных в опубликованных исследованиях колеблется от 59 до 62 лет. Однако, по данным Е. Lahner et а1., среди пациентов с дефицитом витамина В12 около половины — лица моложе 60 лет, причем 4% из них моложе 30 лет, а 10% — лица в возрасте от 30 до 40 лет. Эти данные опровергают мнение о том, что пернициозная анемия является исключительно болезнью пожилых людей, и предполагают, что в клинической практике ПА может быть диагностирована и у более молодых пациентов.
Пернициозная анемия считается аутоиммунным заболеванием из-за часто определяемого наличия аутоантител, направленных против внутреннего фактора и париетальных клеток желудка. Обнаружение в сыворотке крови аутоантител к внутреннему фактору и париетальным клеткам заложило основы для иммунологических объяснений патогенеза гастрита, приводящего к развитию ПА. Пернициозную анемию часто считают синонимом аутоиммунного гастрита, потому что она является заключительным этапом хронического атрофического аутоиммунного гастрита, при котором исчезают париетальные клетки дна и тела желудка. Как правило, от начала хронического атрофического гастрита типа А до появления ПА проходит от 20 до 30 лет.
Патологический процесс, связанный с гастритом типа А, направлен против париетальных клеток желудка. Патологические изменения ограничиваются телом и дном желудка, слизистая оболочка которых характеризуется потерей париетальных клеток. В сыворотке крови и в желудочном соке появляются аутоантитела к париетальным клеткам и продуктам их секреции, в частности к внутреннему фактору. В последнее время установлено, что аутоантитела, направленные против париетальных клеток, распознают расположенную на их поверхности Н+/К+-АТФазу. В то же время пока не доказано, что выявляемые в крови антитела против Н+/К+-АТФазы являются патогенными в естественных условиях, так как желудочные Н+/К+-АТФазы не доступны для циркулирующих антител. Аутоиммунный гастрит характеризуется также утратой и зимогенных клеток желудка, вырабатывающих пепсин, но их утрата является вторичной по отношению к потере париетальных клеток.
Мальабсорбция витамина В12 у больных с ПА связана с нарушением всасывания, опосредованного ВФ. Имеется два патогенетических механизма возникающих нарушений. Первый из них связан с уничтожением и окончательной утратой париетальных клеток слизистой оболочки желудка, что приводит к уменьшению и прекращению выработки внутреннего фактора. Степень поражения слизистой оболочки желудка коррелирует со степенью нарушения секреции ВФ и снижением всасывания витамина В12. Второй механизм связан с блокированием аутоантителами, находящимися в желудочном соке, вВ12-связывающего участка ВФ или всего комплекса ВФ-вВ12, что предотвращает образование комплекса ВФ-вВ12 или его связывание с CUBAM-рецептором.
Аутоиммунный генез заболевания подтверждается наличием клеточной инфильтрации мононуклеарными клетками (лимфоцитами и плазматическими клетками) слизистой оболочки желудка с потерей париетальных и зимогенных клеток, обнаружением аутоантител к париетальным клеткам (у 90% пациентов с пернициозной анемией определяют в сыворотке крови) и внутреннему фактору (выявляют у 90% пациентов с ПА в сыворотке крови или в желудочном соке), восстановлением париетальных и зимогенных клеток после лечения кортикостероидами или иммунодепрессантами, а также семейной предрасположенностью и ассоциацией с аутоиммунными заболеваниями.
Пернициозная анемия часто ассоциируется с хроническим аутоиммунным тиреоидитом (тиреоидитом Хашимото) либо диффузным токсическим зобом (болезнью Грейвса) (у 3-41% пациентов), инсулинзависимым сахарным диабетом (у 3-4%), болезнью Аддисона, первичной недостаточностью яичников, первичным гипопаратиреозом, витилиго (у 2-8%), миастенией, синдромом Ламберта-Итона, гипогаммаглобулинемией взрослых и аутоиммунным полиэндокринным синдромом типа II.
Результаты недавно проведенных экспериментальных и клинических исследований подтверждают участие Н. pylori в патогенезе хронического атрофического гастрита типа А и ПА. Однако до сих пор продолжается обсуждение, можно ли включать ПА в число долгосрочных последствий гастрита, обусловленного Н. pylori. В основе механизма индукции аутоиммунных заболеваний желудка, обусловленных Н. pylori, лежит гипотеза «молекулярной мимикрии». Считается, что инфицирование Н. pylori может играть важную роль в развитии аутоиммунных процессов у генетически предрасположенных пациентов с ПА. При длительном инфицировании Н. pylori активный воспалительный процесс переходит в аутоиммунный, опосредованный аутореактивными CD4+ Т-клетками в слизистой оболочке желудка, которые распознают Н+/К+-АТФазы как антигены Н. pylori. Развивающийся аутоиммунный процесс приводит к необратимому разрушению слизистой оболочки желудка. Для пациентов с ПА и антителами к ВФ характерно повышение индекса Т-хелперы/Т-супрессоры. Отсутствие Н. pylori у части пациентов с ПА, вероятно, означает, что для развившегося аутоиммунного процесса наличие возбудителя не является обязательным.
По данным Е. Lahner et al., за много лет до возникновения пернициозной анемии развиваются ахлоргидрия и атрофия слизистой оболочки желудка, обусловленные действием Н. pylori, которые сопровождаются железодефицитной анемией. Кроме того, одновременно с ПА возможен дефицит железа.
Существует наследственная предрасположенность к возникновению пернициозной анемии: есть сообщения о ее высокой частоте ПА в некоторых семьях на протяжении нескольких поколений. У больных с ПА около 20% родственников также имеют ПА. У них, особенно у родственников первой степени родства, также чаще обнаруживают антитела к париетальным клеткам, чем в обычной популяции. У монозиготных близнецов пернициознаю анемию выявляют в 12 раз чаще. По данным Е. Lahner et al., имеется незначительная, но достоверная корреляция между генотипами HLA-DRB1*03, HLA-DRB1*04 (которые, как известно, связаны с такими аутоиммунными заболеваниями, как инсулинзависимый сахарный диабет, диффузный токсический зоб) и ПА.
Химическое повреждение слизистой оболочки дна и тела желудка
К развитию дефицита витамина В12 может привести химическое повреждение слизистой оболочки желудка с ее значительным повреждением в области дна и тела желудка и, как следствие, нарушением выработки внутреннего фактора.
Эффективное пищеварение – основа жизненных процессов. В условиях нарушенного пищеварения...
Дефицит витамина В12 (ДВ12) — патологическое состояние, характеризующееся недостаточным...
Дефицит витамина В12 (ДВ12) — патологическое состояние, характеризующееся недостаточным...
Дефицит витамина В12 (ДВ12) — патологическое состояние, характеризующееся недостаточным...
В современном мире вряд ли найдется хотя бы один человек, который не принимал витамины. Обычно...
анализы, БАД, биологическая медицина, витамины, гастроэнтерология, гигиена, гинекология, гомеопатия, дерматология, диагностика, диетология, заболевания, иммунология, инфекционные заболевания, инфекция, исследования, кардиология, кожа, косметика, красота, лекарственные растения, лечение, неврология, неонатология, обследование, оздоровление, онкология, ортопедия, педиатрия, питание, пищеварительная система, поведение, похудение, препараты, продукты, профилактика, процедура, психология, пульмонология, рак, реабилитация, сердечно-сосудистая система, ССС, тело, терапия, травматология, уход, фитотерапия, хирургия, эндокринология
Показать все теги

Комменатрии к новости